元素周期律和元素周期表的综合应用 知识点题库
如表是元素周期表的一部分,请参照元素①〜⑦在表中的位置,请用化学用语回答下列问题: 

-
(1) ①〜⑦元素中原子半径最大的是(用元素符号表示);
-
(2) ②、⑦两种元素所形成的气态氢化物中较稳定的是(用化学式表示);
-
(3) ⑤、⑥两种元素最高价氧化物对应水化物的酸性较强的是(用化学式表示)
-
(4) 写出③和⑥两种元素的最高价氧化物对应水化物反应的离子方程式.
在1﹣18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
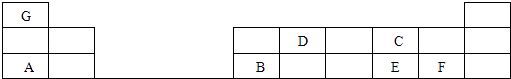
-
(1) D的元素名称为;
-
(2) G和F形成化合物的电子式为;
-
(3) C和E分别形成的气态氢化物中最稳定的是(填写氢化物的化学式)
-
(4) A最高价氧化物的水化物和B的最高价氧化物的水化物反应的化学方程为.
X、Y、Z、M、W为五种短周期元素.X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示.下列说法不正确的是( )
Y | Z | M | |
W |
A . 原子半径:W>Y>Z>M>X
B . 热稳定性:XM>X2Z,沸点:X2Z>YX3
C . X、Y、Z三种元素形成的化合物中不可能含离子键
D . ZM2、YM3、WM4分子中每个原子最外层均满足8电子结构
下表是元素周期表的一部分,回答下列有关问题:
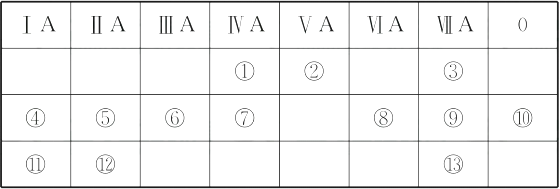
-
(1) 写出下列元素符号:②、⑦、⑧、⑫。
-
(2) 在这些元素中,最活泼的金属元素是(填元素符号,后同),最活泼的非金属元素是,最不活泼的元素是。
-
(3) 在这些元素的最高价氧化物的水化物中,碱性最强的是(填化学式,后同),呈两性的氢氧化物是,写出二者之间相互反应的化学方程式
-
(4) 在①与⑦中,非金属性较强的是(填序号),请列举两项事实加以证明:
。
X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子;Y原子的最外层电子数是内层电子数的2倍;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;M是地壳中含量最高的金属元素。下列说法正确的是( )
A . X、Z、W三元素形成的化合物为共价化合物
B . 五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X
C . 化合物YW2、ZW2都是酸性氧化物
D . 用M单质作阳极,石墨作阴极电解NaHCO3溶液,在阳极区出现白色沉淀
X、Y、Z、W是原子序数依次增大的短周期主族元素,X是原子半径最小的元素;Y元素原子的最外层电子数是电子层数的2倍;Z元素的-1价阴离子、W元素的+3价阳离子的核外电子排布均与氖原子相同。下列说法中正确的是( )
A . X、Y形成的化合物只含有极性键
B . X单质和Z单质在暗处就能剧烈反应
C . 含W元素的盐溶液一定显酸性
D . Z离子半径小于W离子半径
有六种短周期元素,已知A的单质是最清洁的能源物质,其他元素的原子半径及主要化合价如下表:
元素代号 | B | C | D | E | F |
原子半径/nm | 0.186 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +1 | +3 | +6、-2 | +7、-1 | -2 |
根据上述信息回答以下问题。
-
(1) D在元素周期表中的位置;E的离子结构示意图。
-
(2) 关于A元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,试分析其理由。
-
(3) 用电子式表示B的单质与D的单质形成化合物的过程。
-
(4) 下列各项比较,正确的是。
①氢化物的沸点:D低于F ②A~F元素的简单离子半径:C的最大
③气态氢化物稳定性:D比E稳定 ④最高价氧化物对应的水化物碱性:B小于C
-
(5) E单质常用于自来水消毒。用必要的文字和离子方程式解释原因。
-
(6) 写出C的单质与B的最高价氧化物的水化物反应的离子方程式。
-
(7) C的单质与元素M的红棕色氧化物N反应可用于焊接钢轨,该反应的化学方程式为。
-
(8) 已知单质M的燃烧热为375kJ/mol,写出表示其燃烧热的热化学方程式。
-
(9) 已知NH3结合质子的能力强于F的氢化物,请用最恰当的离子方程式证明这个结论。
下图是周期表短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B的质量数,B元素的原子核内质子数等于中子数。下列叙述正确的是 ( )
![]()
A . A,B,C离子半径大小:A>C>B
B . C元素单质是氧化性最强的非金属单质
C . A与C的气态氢化物饱和水溶液的pH:A<C
D . 最高价氧化物对应水化物的酸性:C>B
短周期主族元素X、Y、Z的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z的核电荷数比Y多4。下列说法正确的是( )
A . 原子半径的大小顺序:Z>Y>X
B . Y分别与Z、X形成的化合物中化学键类型相同
C . 单质Z能在X的最高价氧化物中燃烧
D . Y、X的简单气态氢化物的热稳定性:Y<X
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )
A . 元素Y、Z、W离子具有相同的电子层结构,其半径依次增大
B . 元素X与元素Y只能形成一种化合物
C . 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D . 元素W、R的最高价氧化物对应水化物都是强酸
2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法错误的是( )
A . In是第五周期第ⅢA族元素
B . 11549In的中子数与电子数的差值为17
C . 原子半径:In>Al
D . 碱性:In(OH)3>RbOH
有四种短周期元素X、M、Q、R 原子序数依次减小。R的阴离子核外电子排布与He原子的相同,Q与M形成的化合物中有一种为红棕色的气体,X与R属于同一主族。则下列叙述正确的是( )
A . M、Q、R三种元素组成的物质中只含共价键
B . QMX是形成酸雨和雾霾的原因之一
C . X单质常温下与M单质反应,生成X2M2
D . 碳元素与R元素形成的原子个数比为1:1的化合物只有1种
下列事实不能用元素周期律解释的是( )
A .  的碱性强于
的碱性强于 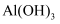 B .
B . 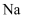 与冷水剧烈反应,
与冷水剧烈反应, 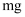 与冷水缓慢反应
C .
与冷水缓慢反应
C .  的稳定性强于H2S
D .
的稳定性强于H2S
D .  的沸点高于
的沸点高于 
 的碱性强于
的碱性强于 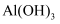 B .
B . 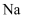 与冷水剧烈反应,
与冷水剧烈反应, 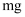 与冷水缓慢反应
C .
与冷水缓慢反应
C .  的稳定性强于H2S
D .
的稳定性强于H2S
D .  的沸点高于
的沸点高于 
元素周期表可分为周期和族,其中 0 族元素又称作( )
A . 稀有气体
B . 卤族元素
C . 碱金属元素
D . 过渡元素
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的核外电子总数等于Y的最外层电子数,Y是地壳中含量最多的元素,Z的原子半径是短周期主族元素原子中最大的,Z在W单质中燃烧产生大量白烟,生成的化合物ZW是厨房常见的调味品。下列说法正确的是( )
A . X与Y只能形成一种化合物
B . 原子半径大小: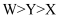 C . Y、W的某些单质均可用作水的消毒剂
D .
C . Y、W的某些单质均可用作水的消毒剂
D .  不能与水反应
不能与水反应
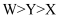 C . Y、W的某些单质均可用作水的消毒剂
D .
C . Y、W的某些单质均可用作水的消毒剂
D .  不能与水反应
不能与水反应
已知A、B、C、D、E、F 均为短周期主族元素,原子序数依次增大。C为地壳中含量最高的元素,E原子的次外层电子数是最外层的2倍,F最高价氧化物对应的水化物酸性比H2SO4强。A、D同主族,B、C同周期,气态化合物甲由A、B两种元素组成,其原子个数比为4∶1。
-
(1) 化合物甲的空间结构。
-
(2) F在周期表中的位置。
-
(3) B,D,E3种元素原子半径由大到小顺序(用元素符号表示)。
-
(4) 用电子式表示D和F形成化合物的过程。
-
(5) B的最高价氧化物和D的一种氧化物能发生反应生成C单质,写出该反应的化学方程式。
Y、Z、U、W为四种短周期非金属元素,它们的原子半径与原子序数的关系如图所示,其中U的单质是人类将太阳能转化为电能的常用材料。下列有关说法错误的是( )
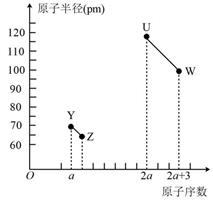
A . 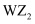 可作自来水的消毒剂
B . U是一种亲氧元素
C . Y、Z的简单气态氢化物的稳定性:Y<Z
D . Y的氧化物对应的水化物一定是强酸
可作自来水的消毒剂
B . U是一种亲氧元素
C . Y、Z的简单气态氢化物的稳定性:Y<Z
D . Y的氧化物对应的水化物一定是强酸
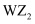 可作自来水的消毒剂
B . U是一种亲氧元素
C . Y、Z的简单气态氢化物的稳定性:Y<Z
D . Y的氧化物对应的水化物一定是强酸
可作自来水的消毒剂
B . U是一种亲氧元素
C . Y、Z的简单气态氢化物的稳定性:Y<Z
D . Y的氧化物对应的水化物一定是强酸
中国画传统黄色颜料雄黄和雌黄均为As的硫化物,二者的球棍模型如图所示,已知As位于元素周期表中第四周期ⅤA族,下列说法错误的是( )
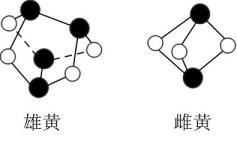
A . 模型中白球代表硫原子
B . 非金属性: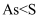 C . 雄黄和雌黄中As元素均为+3价
D . 雄黄的化学式为
C . 雄黄和雌黄中As元素均为+3价
D . 雄黄的化学式为
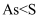 C . 雄黄和雌黄中As元素均为+3价
D . 雄黄的化学式为
C . 雄黄和雌黄中As元素均为+3价
D . 雄黄的化学式为
已知W、X、Y、Z均为短周期元素,常温下,它们的最高价氧化物对应的水化物溶液(浓度均为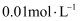 )的pH和原子半径、原子序数的关系如图所示。下列说法正确的是( )
)的pH和原子半径、原子序数的关系如图所示。下列说法正确的是( )
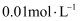 )的pH和原子半径、原子序数的关系如图所示。下列说法正确的是( )
)的pH和原子半径、原子序数的关系如图所示。下列说法正确的是( )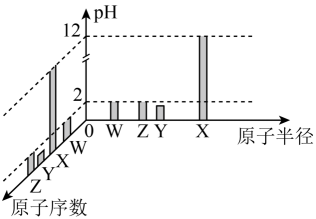
A . 电负性:Z<Y
B . 简单离子半径:Z>Y>W>X
C . 元素W形成的某阳离子 空间构型为正四面体
D . 化合物
空间构型为正四面体
D . 化合物 中含有极性共价键和非极性共价键
中含有极性共价键和非极性共价键
 空间构型为正四面体
D . 化合物
空间构型为正四面体
D . 化合物 中含有极性共价键和非极性共价键
中含有极性共价键和非极性共价键
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子2p轨道上有2个未成对电子,Y是地壳中含量最高的元素,金属元素Z的第一电离能小于同周期前一主族元素。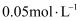 的W的最高价氧化物对应的水化物溶液的pH=1。下列说法正确的是( )
的W的最高价氧化物对应的水化物溶液的pH=1。下列说法正确的是( )
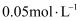 的W的最高价氧化物对应的水化物溶液的pH=1。下列说法正确的是( )
的W的最高价氧化物对应的水化物溶液的pH=1。下列说法正确的是( )
A . Y原子和W原子按2:1形成的分子空间构型为直线形
B . X氢化物的沸点都比Y的低
C . 工业上常用电解熔融氧化物的方法冶炼乙单质
D . 原子半径: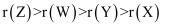
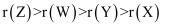
最近更新



