元素周期律和元素周期表的综合应用 知识点题库
四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题.
W | X | Y | Z | |
结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
-
(1) Z在元素周期表中位于族.
-
(2) 上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是(填元素符号).
-
(3) ①下列可作为比较X和Y金属性强弱的依据是(填序号).
a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因:.
-
(4) W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是,混合后溶液中离子浓度由大到小的顺序是.
-
(5) Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.

能确定混合物中Y的质量分数的数据有(填序号).
a.m、n b.m、y c.n、y.
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
-
(1) ④、⑤、⑥的原子半径由大到小的顺序是.
-
(2) ②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是.
-
(3) ①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:.
-
(4) 由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号).
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4 .
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ |
请回答:
-
(1) 以上元素中,最高价氧化物对应水化物酸性最强的是;碱性最强的是;显两性的是(填化学式)
-
(2) ③、④、⑨三种元素按原子半径由大到小的顺序依次为(填元素符号)
-
(3) 按要求写出下列两种物质的电子式:⑥的氢化物; ⑨的最高价氧化物的对应的水化物;
-
(4) 由H和①形成的原子数之比为1:1的物质 (填化学式).
-
(5) 利用⑧的单质制备漂白粉发生反应的化学方程式为.
-
(6) ⑤的最高价氧化物对应的水化物既能与③的最高价氧化物对应的水化物反应,也能与⑧的最高价氧化物对应的水化物反应.分别写出其反应的离子方程式是;.
短周期的四种元素位置如图所示,若四种元素的核电荷数之和为52,则与四种元素推断相关的描述不正确的是( )
![]()
A . A的最高价氧化物用于制作光导纤维
B . B的最高价氧化物的水化物是一种强酸
C . C至少有两种价态的氧化物
D . D的一种单质是空气中含量最多的气体
有X、Y、Z、W四种短周期元素,它们的核电荷数依次增大.只有Z是金属元素,X最外层只有一个电子,Y和W元素原子的最外层电子数相同,且Y元素原子L 层电子数是K层电子数的3倍,Z元素原子的最外层电子数是W元素原子最外层电子数的一半.请回答:
-
(1) Z是(填元素符号),W的原子结构示意图为.
-
(2) 写出两种仅由X、Y两种元素的原子形成的10电子微粒的符号.
-
(3) 已知标准状况下,2gX的单质气体在Y的单质气体(空气主要成分之一)中充分燃烧放出285.8kJ的热量,该反应的热化学方程式为.
-
(4) 将X的单质气体与Y的单质气体间的反应设计成原电池反应,简易装置如图所示.A处通入的气体为,B处气体发生反应的电极反应式为.

X、Y、Z、W为短周期主族元素,X原子M层有1个电子,Y原子最外层电子数为最内层电子数的2倍,Z元素的最高化合价为最低化合价绝对值的3倍,Z、W同周期,W的原子半径小于Z。下列叙述正确的是( )
A . 原子半径由大到小的顺序:Z、X、Y
B . 元素非金属性由强到弱的顺序:W、Z、Y
C . 简单气态氢化物的稳定性由强到弱的顺序:Z、W
D . W分别与X、Y形成的化合物化学键类型相同
有研究人员设计了如下利用含硫物质热化学循环实现太阳能的转化与存储的过程。

回答下列问题:
-
(1) 反应Ⅰ中,主要能量转化形式为能转化为能。
-
(2) S在元素周期表中位于第 周期第族。
-
(3) 下列事实中,能说明硫的非金属性比碳强的是 (填标号)。A . H2SO3的酸性比H2CO3的酸性强 B . 在硫与碳的化合物CS2中S显负价 C . 硫的单质的硬度比金刚石低
-
(4) 配平反应Ⅱ的化学方程式: SO2+H2O= H2SO4+S,该反应中氧化剂是。
-
(5) 通过反应Ⅲ也可以不经过热能转化过程而直接获取电能,化学上将实现这一直接转化的装置称为 。
根据元素周期表和元素周期律,判断下列叙述错误的是( )
A . 气态氢化物的稳定性:H2O>NH3>SiH4
B . 氢元素与其他元素可形成共价化合物或离子化合物
C . 如图所示实验可证明元素的非金属性:Cl>C>Si  D . 用中文“
D . 用中文“  ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
 D . 用中文“
D . 用中文“
X、Y、Z、W是原子序数依次增大的短周期主族元素,X的族序数是周期的2倍,Y原子的最外层电子数等于X原子的核外电子总数,Z的单质能与冷水剧烈反应产生H2 , W与Y同主族。下列说法正确的是( )
A . 四种元素中Z的原子半径最大
B . Y的简单气态氢化物的热稳定性比W的弱
C . Y、Z两种元素形成的化合物一定只含离子键
D . X、Y、Z三种元素形成的常见化合物的水溶液呈酸性
W、X、Y、Z 均为短周期主族元素,X与Z同族,X核外电子总数等于Y最外层电子数,Y是短周期中非金属性最强的元素,W与Z的最高化合价之和为8, 且W原子半径小于Z。下列叙述正确的是( )
A . 气态简单氢化物的稳定性:Z>X>W
B . W和Y可形成共价化合物WY3 , 且WY3中W、Y均满足最外层 8 电子稳定结构
C . 常温下,0.1 mol•L-1Z的最高价氧化物对应水合物水溶液的 pH >1
D . 常温下,与W同族且相邻元素的单质能溶于X的最高价氧化物对应水化物的浓溶液。
元素周期表短周期中六种元素的原子序数与主要化合价的关系如图:

-
(1) 元素F在周期表中的位置是 。
-
(2) 元素C,D,E原子半径由大到小的顺序是 (填元素符号)。
-
(3) A、B、C的单质与氢气反应的难易程度由易到难的顺序是 (用单质的化学式表示)。
-
(4) 应用元素周期律和元素周期表的知识,写出D和E所形成的化合物的化学式 、(写2种)。
-
(5) D在B单质中燃烧生成的物质电子式为,氢原子与B原子以1:1结合的物质结构式为 。
-
(6) 根据氯、溴、碘单质间的置换反应,判断F的单质和E的最简单氢化物之间能否发生反应(填“能”或“不能”),若能则写出反应的化学方程式 。
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出)

-
(1) 若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,③与④两个反应中都有红棕色气体生成,反应④的离子方程式是,用电子式表示C的形成过程,六种物质中所有元素的原子半径由大到小的顺序为(用元素符号表示)。
-
(2) 若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则C的化学式为,E的结构式为,A、D、F所对应元素的气态氢化物的稳定性,由强到弱的顺序是(用化学式表示),反应①的化学方程式是。
-
(3) 若B、C、F都是气态单质,且B为黄绿色,③和④两个反应中都有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,反应①的化学方程式是,在反应中若有3mol电子转移,则生成C的物质的量为。
X、Y都是ⅡA族(Be除外)的元素,已知它们的碳酸盐的热分解温度:T(XCO3)>T(YCO3),则下列判断错误的是( )
A . 晶格能:XCO3>YCO3
B . 阳离子半径:X2+>Y2+
C . 金属性:X>Y
D . 氧化物的熔点:XO<YO
短周期元素A、B、C、D、E的原子序数依次增大;A的最高价氧化物与B的氢化物在水中反应得到的生成物既可与酸反应又可与碱反应;C、D为金属元素,且D原子最外层电子数等于其K层电子数,而C的阳离子半径大于D的阳离子;若往E单质的水溶液中滴加少量紫色石蕊试液,能观察到先变红后褪色。下列说法中正确的是( )
A . 金属D能在A的最高价氧化物中燃烧,生成A的化合物
B . B的氢化物和E的氢化物能相互反应,且得到的产物只含有共价键
C . C在元素周期表中的位置是第三周期第ⅠA族
D . E单质的水溶液使紫色石蕊试液先变红后褪色,说明E单质具有漂白性
黝帘石的化学式是 E2C3AD3B13 , A 、B、C 、D、E 为五种不同主族的原子序数依次增大的前20 号元素; 其中A 、B 、C、E 四种位于不同周期,这五种元素原子序数和为 56,B 的最外层电子数为其电子层数的三倍。下列说法错误的是( )
A . 最简单氢化物的热稳定性:B>D
B . 氯元素分别和D,B 形成的化合物均为共价化合物
C . B ,C ,E 的简单离子半径:E>B>C
D . C 的最高价氧化物对应的水化物是强碱
硒(Se)是第4周期第ⅥA族元素,下列叙述错误的是( )
A . 硒是一种金属性很强的元素
B . 硒可以形成SeO2和SeO3
C . 硒的氢化物化学式为H2Se
D . 硒的最高价氧化物对应水化物的化学式是H2SeO4
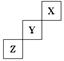
短周期元素X、Y、Z在周期表中位置关系如图所示。
-
(1) X元素的单质分子式是。若X核内中子数与质子数相等,X单质的摩尔质量是。
-
(2) Y单质的电子式是。
Y单质与水反应的化学方程式:。
Z与钠形成的化合物的电子式是:。
现有1~20号元素A、B、C、D所对应的物质的性质或微粒结构如下表:
|
元素 |
物质性质或微粒结构 |
|
A |
M层上有2对成对电子 |
|
B |
B的一种核素在考古时常用来鉴定一些文物的年代 |
|
C |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
D |
元素最高正价是+7价 |
-
(1) 元素A的原子最外层共有种不同运动状态的电子,有种能量不同的电子。
-
(2) C的氢化物固态时属于晶体,其中C原子杂化方式为,C的氢化物比D的氢化物更易溶于水的主要原因是。
-
(3) 元素B形成带2个单位负电荷的离子
 ,其电子式为(用元素符号表示,下同)。
,其电子式为(用元素符号表示,下同)。
-
(4) B的一种氧化物容易引起中毒,根据等电子原理写出其结构式。
-
(5) 下列表述正确且能证明元素A与元素D非金属性强弱的是________。A . A的氢化物比D的氢化物稳定 B . 常温下A的单质和D的单质状态不同 C . D的氢化物的酸性比A的氢化物的酸性强 D . 一定条件下D的单质能从A的氢化物水溶液中置换出A单质 E . D的氢化物的还原性比A的氢化物的还原性强
-
(6) 测知D的钠盐晶体中相邻的Na+与D-的距离为acm,该晶体密度为dg•cm-3 , 则阿伏加德罗常数可表示为_______。A .
 B .
B .  C .
C .  D .
D . 

1772年卢瑟福通过蜡烛在空气中燃烧,在剩余气体中发现了X2.1823年贝采利乌斯用金属Y还原ZW4得到单质Z。已知Y在前四周期主族元素中原子半径最大,Z的原子序数大于W且二者原子序数之和23.下列有关说法正确的是( )
A . 单质沸点Z>Y
B . 原子最外层电子数:X>W
C . 简单氢化物的稳定性:W>Z>X
D . X、Y、Z均可以与W形成共价化合物
某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,X、W为同族,Q原子核外最外层电子数与Y原子核外电子总数相同。下列叙述正确的是( )

A . 元素非金属性的顺序为:Q>Y>Z>X
B . Z的氧化物对应的水化物是一种一元强酸
C . 由X、Y、Q、W四种元素形成的化合物的水溶液可能呈酸性
D . ZX3可以使湿润的蓝色石蕊试纸变红
最近更新



