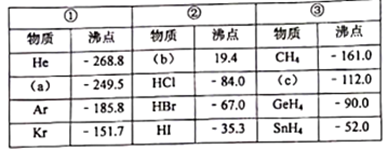
е…ғзҙ е‘ЁжңҹеҫӢе’Ңе…ғзҙ е‘ЁжңҹиЎЁзҡ„з»јеҗҲеә”з”Ё зҹҘиҜҶзӮ№йўҳеә“
пјҲ1пјүйқһйҮ‘еұһжҖ§жңҖејәзҡ„е…ғзҙ жҳҜгҖҖ гҖҖпјҢеңЁеҸҚеә”дёӯжҳ“ пјҲеЎ«вҖңеҫ—вҖқжҲ–вҖңеӨұвҖқпјүз”өеӯҗпјӣ
пјҲ2пјү第3е‘ЁжңҹдёӯпјҢеҺҹеӯҗеҚҠеҫ„жңҖеӨ§зҡ„е…ғзҙ пјҲзЁҖжңүж°”дҪ“е…ғзҙ йҷӨеӨ–пјүжҳҜгҖҖ гҖҖпјҢйқһйҮ‘еұһжҖ§жңҖејәзҡ„е…ғзҙ жҳҜгҖҖ гҖҖпјӣе…¶жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©й…ёжҖ§жңҖејәзҡ„жҳҜ гҖҖпјҺ
пјҲ3пјүв…ӨAж—ҸдёӯпјҢеҺҹеӯҗеҚҠеҫ„жңҖе°Ҹзҡ„е…ғзҙ жҳҜгҖҖ гҖҖпјҢе…¶ж°”жҖҒж°ўеҢ–зү©дёәгҖҖ гҖҖпјҺ
пјҲ4пјүCгҖҒSiгҖҒSдёүз§Қе…ғзҙ дёӯпјҢйҖӮеҗҲеҒҡеҚҠеҜјдҪ“жқҗж–ҷзҡ„жҳҜ
-
пјҲ1пјү еҶҷеҮәе…ғзҙ зҡ„еҗҚз§°пјҡCпјҢDпјӣ
-
пјҲ2пјү еҶҷеҮәе…ғзҙ зҡ„еҺҹеӯҗз»“жһ„еӣҫпјҡ
AпјҢBпјҢдәҢиҖ…зҰ»еӯҗеҚҠеҫ„пјҡпјҲеЎ«зҰ»еӯҗз¬ҰеҸ·пјүпјҺ
-
пјҲ3пјү AпјҢBзҡ„жңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©зҡ„зўұжҖ§пјһпјҲеЎ«еҢ–еӯҰејҸпјҢдёӢеҗҢпјү
-
пјҲ4пјү DпјҢEзҡ„ж°”жҖҒж°ўеҢ–зү©зҡ„зЁіе®ҡжҖ§пјҡпјһпјҺ
-
пјҲ1пјү AгҖҒBгҖҒCзҡ„第дёҖз”өзҰ»иғҪз”ұе°ҸеҲ°еӨ§зҡ„йЎәеәҸдёәпјҲз”Ёе…ғзҙ з¬ҰеҸ·иЎЁзӨәпјүпјҺ
-
пјҲ2пјү MжҳҜеҗ«жңүпјҲеЎ«вҖңжһҒжҖ§вҖқжҲ–вҖңйқһжһҒжҖ§вҖқпјүе…ұд»·й”®зҡ„пјҲеЎ«вҖңжһҒжҖ§вҖқжҲ–вҖңйқһжһҒжҖ§вҖқпјүеҲҶеӯҗпјҺ
-
пјҲ3пјү WеҲҶеӯҗзҡ„з©әй—ҙжһ„еһӢдёәпјҺ

-
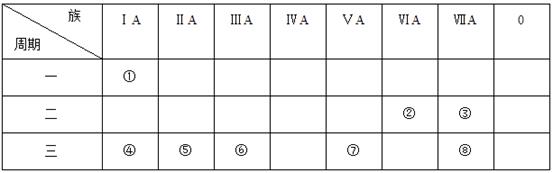
пјҲ1пјү е…ғзҙ в‘ўеҚ•иҙЁзҡ„еҢ–еӯҰејҸдёәпјҢв‘ е’Ңв‘ЈдёӨз§Қе…ғзҙ еҪўжҲҗеҢ–еҗҲзү©зҡ„з”өеӯҗејҸдёәгҖӮз”ұв‘ в‘Ўз»„жҲҗдё”еҗ«жңүйқһжһҒжҖ§й”®зҡ„зү©иҙЁзҡ„з»“жһ„ејҸдёәгҖӮ
-
пјҲ2пјү в‘Ј-⑧5з§Қе…ғзҙ жүҖеҪўжҲҗзҡ„жңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©дёӯпјҢзўұжҖ§жңҖејәзҡ„жҳҜпјҢй…ёжҖ§жңҖејәзҡ„жҳҜпјҢеұһдәҺдёӯејәй…ёзҡ„жҳҜ(еқҮеЎ«еҢ–еӯҰејҸ)гҖӮ
-
пјҲ3пјү в‘Је’Ңв‘ҘдёӨз§Қе…ғзҙ зҡ„жңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©пјҢеңЁж°ҙдёӯеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәгҖӮ
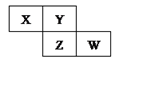
|
е‘Ёжңҹ |
в… A |
в…ЎA |
в…ўA |
в…ЈA |
в…ӨA |
в…ҘA |
в…ҰA |
0 |
|
2 |
|
|
|
| | | |
|
| 3 | |
| | |
| | | |
-
пјҲ1пјү в‘ вҖ”в‘©дёӯпјҢжңҖжҙ»жіјзҡ„йҮ‘еұһе…ғзҙ жҳҜ(еҶҷе…ғзҙ з¬ҰеҸ·)пјӣжңҖдёҚжҙ»жіјзҡ„е…ғзҙ жҳҜ(еҶҷе…ғзҙ з¬ҰеҸ·)гҖӮ
-
пјҲ2пјү в‘ЈгҖҒв‘Өзҡ„з®ҖеҚ•зҰ»еӯҗпјҢе…¶еҚҠеҫ„жӣҙеӨ§зҡ„жҳҜ(еҶҷзҰ»еӯҗз¬ҰеҸ·)гҖӮ
-
пјҲ3пјү ⑧гҖҒв‘Ёзҡ„ж°”жҖҒж°ўеҢ–зү©пјҢжӣҙзЁіе®ҡзҡ„жҳҜ(еЎ«еҢ–еӯҰејҸ)гҖӮ
-
пјҲ4пјү е…ғзҙ зҡ„йқһйҮ‘еұһжҖ§пјҡв‘ в‘Ұ(еЎ«вҖң>вҖқжҲ–вҖң<вҖқ)гҖӮ
-
пјҲ5пјү в‘ вҖ”в‘Ёзҡ„жңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©дёӯпјҡй…ёжҖ§жңҖејәзҡ„жҳҜ(еЎ«еҢ–еӯҰејҸ)пјҢж—ўиғҪдёҺй…ёеҸҚеә”еҸҲиғҪдёҺзўұеҸҚеә”зҡ„жҳҜ(еЎ«еҢ–еӯҰејҸ)пјҺ
в‘ й…ёжҖ§пјҡHClO4>HBrO4>HIO4 в‘ЎзўұжҖ§пјҡBa(OH)2>Mg(OH)2>Be(OH)2
в‘ўж°§еҢ–жҖ§пјҡF>C>O в‘ЈиҝҳеҺҹжҖ§пјҡCl<S<Si
в‘Өж°”жҖҒж°ўеҢ–зү©зЁіе®ҡжҖ§пјҡHFпјһHClпјһH2S
|
ж—Ҹ е‘Ёжңҹ |
пј©A |
в…ЎA |
в…ўA |
в…ЈA |
в…ӨA |
в…ҘA |
в…ҰA |
0 |
|
2 |
в‘ |
в‘Ў |
в‘ў |
в‘Ј |
||||
|
3 |
в‘Ө |
в‘Ҙ |
в‘Ұ |
⑧ |
в‘Ё |
в‘© |
-
пјҲ1пјү в‘Ўзҡ„еҺҹеӯҗз»“жһ„зӨәж„ҸеӣҫжҳҜгҖӮ
-
пјҲ2пјү еҢ–еӯҰжҖ§иҙЁжңҖдёҚжҙ»жіјзҡ„е…ғзҙ жҳҜпјҲеЎ«е…ғзҙ з¬ҰеҸ·пјүгҖӮ
-
пјҲ3пјү в‘ўе’Ңв‘ЈеҺҹеӯҗдёӯпјҢеҺҹеӯҗеҚҠеҫ„иҫғеӨ§зҡ„жҳҜпјҲеЎ«е…ғзҙ з¬ҰеҸ·пјүгҖӮ
-
пјҲ4пјү еёёз”ЁдҪңеҚҠеҜјдҪ“жқҗж–ҷзҡ„жҳҜпјҲеЎ«еҗҚз§°пјүгҖӮ
-
пјҲ5пјү ⑧гҖҒв‘Ёзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©дёӯй…ёжҖ§иҫғејәзҡ„жҳҜпјҲеЎ«еҢ–еӯҰејҸпјүгҖӮ
-
пјҲ6пјү з„°иүІеҸҚеә”жҳҫй»„иүІзҡ„зү©иҙЁжүҖеҗ«зҡ„йҮ‘еұһе…ғзҙ жҳҜпјҲеЎ«е…ғзҙ з¬ҰеҸ·пјүгҖӮ
-
пјҲ7пјү е…ғзҙ жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©дёӯпјҢе‘ҲдёӨжҖ§зҡ„жҳҜпјҲеЎ«еҢ–еӯҰејҸпјүгҖӮ
-
пјҲ8пјү з»“жһ„з®ҖејҸдёә
 зҡ„жңүжңәзү©еҲҶеӯҗејҸжҳҜпјҢе…¶дёӯзўіе…ғзҙ дёҺж°ўе…ғзҙ зҡ„иҙЁйҮҸжҜ”mпјҲCпјүвҲ¶пјҲHпјү=гҖӮ
зҡ„жңүжңәзү©еҲҶеӯҗејҸжҳҜпјҢе…¶дёӯзўіе…ғзҙ дёҺж°ўе…ғзҙ зҡ„иҙЁйҮҸжҜ”mпјҲCпјүвҲ¶пјҲHпјү=гҖӮ
| йҖүйЎ№ | зӣ®зҡ„ | ж“ҚдҪң |
| A | йҷӨеҺ»CuзІүдёӯж··жңүзҡ„CuO | еҠ е…ҘзЁҖзЎқй…ёпјҢиҝҮж»ӨгҖҒжҙ—ж¶ӨгҖҒе№ІзҮҘ |
| B | жҺўз©¶жё©еәҰеҜ№Fe3+ж°ҙи§ЈзЁӢеәҰзҡ„еҪұе“Қ | еҗ‘25 mLеҶ·ж°ҙе’ҢжІёж°ҙдёӯеҲҶеҲ«ж»ҙе…Ҙ5ж»ҙйҘұе’ҢFeCl3жә¶ж¶ІпјҢжҜ”иҫғжә¶ж¶ІйўңиүІ |
| C | иҜҒжҳҺз”ІиӢҜдёӯзҡ„з”ІеҹәиғҪеӨҹжҙ»еҢ–иӢҜзҺҜ | еҲҶеҲ«еҸ–з”ІиӢҜе’ҢиӢҜдёҺй…ёжҖ§KMnO4жә¶ж¶ІеҸҚеә”пјҢи§ӮеҜҹй…ёжҖ§KMnO4жә¶ж¶Ізҡ„иӨӘиүІжғ…еҶө |
| D | иҜҒжҳҺйқһйҮ‘еұһжҖ§пјҡCl>S | еҗ‘Na2Sжә¶ж¶Ідёӯж»ҙеҠ ж–°еҲ¶ж°Ҝж°ҙпјҢи§ӮеҜҹе®һйӘҢзҺ°иұЎ |


-
пјҲ1пјү дёӢеҲ—иЎЁиҝ°дёӯиғҪиҜҒжҳҺе…ғзҙ в‘ҰдёҺе…ғзҙ ⑧йқһйҮ‘еұһжҖ§ејәејұе…ізі»зҡ„жҳҜгҖӮ
aпјҺеёёжё©дёӢв‘Ұзҡ„еҚ•иҙЁе’Ң⑧зҡ„еҚ•иҙЁзҠ¶жҖҒдёҚеҗҢ
bпјҺ⑧зҡ„ж°ўеҢ–зү©жҜ”в‘Ұзҡ„ж°ўеҢ–зү©зЁіе®ҡ
cпјҺдёҖе®ҡжқЎд»¶дёӢв‘Ұе’Ң⑧зҡ„еҚ•иҙЁйғҪиғҪдёҺж°ўж°§еҢ–й’ жә¶ж¶ІеҸҚеә”
d. е…ғзҙ ⑧зҡ„ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©й…ёжҖ§ејәдәҺе…ғзҙ в‘Ұзҡ„ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©й…ёжҖ§
-
пјҲ2пјү 第дёүе‘ЁжңҹдёӯпјҢеҺҹеӯҗеҚҠеҫ„жңҖеӨ§зҡ„е…ғзҙ жҳҜпјҲеЎ«е…ғзҙ з¬ҰеҸ·пјүпјҢз®ҖеҚ•зҰ»еӯҗеҚҠеҫ„жңҖе°Ҹзҡ„жҳҜпјҲеЎ«еҢ–еӯҰејҸпјүгҖӮ
-
пјҲ3пјү в‘ЈдёҺ⑧еҸҜд»ҘеҪўжҲҗпјҲеЎ«зҰ»еӯҗжҲ–е…ұд»·пјүеҢ–еҗҲзү©пјҢиҜ·з”Ёз”өеӯҗејҸиЎЁзӨәе…¶еҪўжҲҗиҝҮзЁӢпјҡгҖӮ