й«ҳдёӯ еҢ–еӯҰ
 5Cl-+ClO3-+3H2OгҖӮиҜҘе…ҙи¶Је°Ҹз»„и®ҫи®ЎдәҶдёӢеҲ—е®һйӘҢиЈ…зҪ®пјҢиҝӣиЎҢе®һйӘҢгҖӮ
5Cl-+ClO3-+3H2OгҖӮиҜҘе…ҙи¶Је°Ҹз»„и®ҫи®ЎдәҶдёӢеҲ—е®һйӘҢиЈ…зҪ®пјҢиҝӣиЎҢе®һйӘҢгҖӮ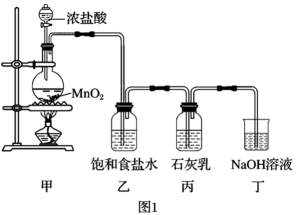
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү иЈ…зҪ®з”Іе’ҢдёҒдёӯеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸеҲҶеҲ«жҳҜгҖҒгҖӮ
-
пјҲ2пјү иҜҘе…ҙи¶Је°Ҹз»„з”ЁиҝҮйҮҸжө“зӣҗй…ёдёҺ8.7 g MnO2еҲ¶еӨҮж°Ҝж°”пјҢ并е°ҶжүҖеҫ—ж°Ҝж°”дёҺиҝҮйҮҸзҡ„зҹізҒ°д№іеҸҚеә”пјҢеҲҷзҗҶи®әдёҠжңҖеӨҡеҸҜеҲ¶еҫ—Ca(ClO)2gгҖӮ
-
пјҲ3пјү дёәдәҶжҺўз©¶еҸҚеә”жқЎд»¶еҜ№дә§зү©зҡ„еҪұе“ҚпјҢ他们еҸҰеҸ–дёҖе®ҡйҮҸзҡ„зҹізҒ°д№іпјҢзј“ж…ўгҖҒеҢҖйҖҹең°йҖҡе…Ҙи¶ійҮҸж°Ҝж°”пјҢеҫ—еҮәдәҶClO-гҖҒClO
 дёӨз§ҚзҰ»еӯҗзҡ„зү©иҙЁзҡ„йҮҸ(n)дёҺеҸҚеә”ж—¶й—ҙ(t)зҡ„е…ізі»жӣІзәҝпјҢзІ—з•ҘиЎЁзӨәдёәеӣҫ2(дёҚиҖғиҷ‘ж°Ҝж°”е’Ңж°ҙзҡ„еҸҚеә”)гҖӮ
дёӨз§ҚзҰ»еӯҗзҡ„зү©иҙЁзҡ„йҮҸ(n)дёҺеҸҚеә”ж—¶й—ҙ(t)зҡ„е…ізі»жӣІзәҝпјҢзІ—з•ҘиЎЁзӨәдёәеӣҫ2(дёҚиҖғиҷ‘ж°Ҝж°”е’Ңж°ҙзҡ„еҸҚеә”)гҖӮ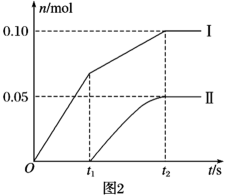
в‘ еӣҫдёӯжӣІзәҝIиЎЁзӨәзҰ»еӯҗзҡ„зү©иҙЁзҡ„йҮҸйҡҸеҸҚеә”ж—¶й—ҙеҸҳеҢ–зҡ„е…ізі»гҖӮ
в‘ЎжүҖеҸ–зҹізҒ°д№ідёӯеҗ«жңүCa(OH)2зҡ„зү©иҙЁзҡ„йҮҸдёәmolгҖӮ
-
пјҲ4пјү е®һйӘҢз»“жқҹеҗҺе°Ҹз»„жҲҗе‘ҳеҸ‘зҺ°пјҢдә§зү©дёӯCa(ClO)2зҡ„иҙЁйҮҸжҳҺжҳҫе°ҸдәҺзҗҶи®әеҖјгҖӮдёәдәҶжҸҗй«ҳCa(ClO)2зҡ„дә§зҺҮпјҢеҸҜеҜ№дёҷиЈ…зҪ®дҪңйҖӮеҪ“ж”№иҝӣгҖӮдҪ з»ҷеҮәзҡ„жҺӘж–ҪжҳҜгҖӮ
-
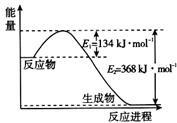
пјҲ1пјү еӣҫжҳҜ1 mol NO2е’Ң1 mol COеҸҚеә”з”ҹжҲҗCO2 е’ҢNOиҝҮзЁӢдёӯзҡ„иғҪйҮҸеҸҳеҢ–зӨәж„ҸеӣҫпјҢиҜ·еҶҷеҮәNO2 е’ҢCOеҸҚеә”зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸгҖӮ
-
пјҲ2пјү еңЁ0.5 Lзҡ„еҜҶй—ӯе®№еҷЁдёӯпјҢдёҖе®ҡйҮҸзҡ„ж°®ж°”е’Ңж°ўж°”иҝӣиЎҢеҰӮдёӢеҢ–еӯҰеҸҚеә”пјҡN2(g)+3H2(g)
 2NH3(g) О”Hпјң0пјҢе…¶еҢ–еӯҰе№іиЎЎеёёж•°KдёҺжё©еәҰTзҡ„е…ізі»еҰӮдёӢиЎЁпјҡ
2NH3(g) О”Hпјң0пјҢе…¶еҢ–еӯҰе№іиЎЎеёёж•°KдёҺжё©еәҰTзҡ„е…ізі»еҰӮдёӢиЎЁпјҡ T/в„ғ
200
300
400
K
K1
K2
0.5
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
в‘ иҜ•жҜ”иҫғK1гҖҒK2зҡ„еӨ§е°ҸпјҢK1K2(еЎ«вҖқпјһвҖқвҖң=вҖңжҲ–вҖқпјңвҖқ)гҖӮ
в‘ЎдёӢеҲ—еҗ„йЎ№иғҪдҪңдёәеҲӨж–ӯиҜҘеҸҚеә”иҫҫеҲ°еҢ–еӯҰе№іиЎЎзҠ¶жҖҒзҡ„дҫқжҚ®жҳҜ(еЎ«еәҸеҸ·еӯ—жҜҚ)гҖӮ
aпјҺе®№еҷЁеҶ…N2гҖҒH2гҖҒNH3зҡ„жө“еәҰд№ӢжҜ”дёә1пјҡ3пјҡ2 bпјҺvжӯЈ(N2)=3vйҖҶ(H2)
cпјҺе®№еҷЁеҶ…еҺӢејәдҝқжҢҒдёҚеҸҳ dпјҺж··еҗҲж°”дҪ“зҡ„еҜҶеәҰдҝқжҢҒдёҚеҸҳ
в‘ў400в„ғж—¶пјҢеҸҚеә”2NH3(g)
 N2(g)+3H2(g)зҡ„е№іиЎЎеёёж•°KдёәгҖӮеҪ“жөӢеҫ—NH3гҖҒN2гҖҒH2зҡ„жө“еәҰеҲҶеҲ«дёә3 mol вҖў LвҲ’1гҖҒ2 mol вҖў LвҲ’1гҖҒ1 mol вҖў LвҲ’1ж—¶пјҢеҲҷиҜҘеҸҚеә”зҡ„vжӯЈ(N2)vйҖҶ(N2)(еЎ«вҖқпјһвҖқвҖң=вҖңжҲ–вҖқпјңвҖқ)
N2(g)+3H2(g)зҡ„е№іиЎЎеёёж•°KдёәгҖӮеҪ“жөӢеҫ—NH3гҖҒN2гҖҒH2зҡ„жө“еәҰеҲҶеҲ«дёә3 mol вҖў LвҲ’1гҖҒ2 mol вҖў LвҲ’1гҖҒ1 mol вҖў LвҲ’1ж—¶пјҢеҲҷиҜҘеҸҚеә”зҡ„vжӯЈ(N2)vйҖҶ(N2)(еЎ«вҖқпјһвҖқвҖң=вҖңжҲ–вҖқпјңвҖқ)
-
пјҲ1пјү еӣҫдёӯжүҖзӨәеҸҚеә”жҳҜ(еЎ«вҖңеҗёзғӯвҖқжҲ–вҖңж”ҫзғӯвҖқ)еҸҚеә”пјҢиҜҘеҸҚеә”зҡ„в–іH=(з”Ёеҗ«E1гҖҒE2зҡ„д»Јж•°ејҸиЎЁзӨә)гҖӮ
-
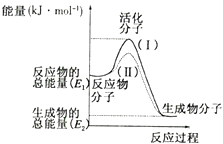
пјҲ2пјү дёӢеҲ—4дёӘеҸҚеә”дёӯз¬ҰеҗҲзӨәж„ҸеӣҫжҸҸиҝ°зҡ„еҸҚеә”зҡ„жҳҜ____________(еЎ«д»ЈеҸ·)гҖӮA . ж°ҙи’ёж°”дёҺзӮӯеҸҚеә” B . з”Ёж°ҙзЁҖйҮҠж°ўж°§еҢ–й’ жә¶ж¶І C . й“қзІүдёҺFe2O3еҸҚеә” D . зҒјзғӯзҡ„зўідёҺCO2еҸҚеә”
-
пјҲ3пјү е·ІзҹҘзғӯеҢ–еӯҰж–№зЁӢејҸпјҡH2(g)+
 O2 (g)=H2O(g)в–іH=-241.8kJ/molгҖӮиҜҘеҸҚеә”зҡ„жҙ»еҢ–иғҪдёә167.2 kJ/molпјҢеҲҷе…¶йҖҶеҸҚеә”зҡ„жҙ»еҢ–иғҪдёәгҖӮ
O2 (g)=H2O(g)в–іH=-241.8kJ/molгҖӮиҜҘеҸҚеә”зҡ„жҙ»еҢ–иғҪдёә167.2 kJ/molпјҢеҲҷе…¶йҖҶеҸҚеә”зҡ„жҙ»еҢ–иғҪдёәгҖӮ
-
пјҲ4пјү д»Ҙз”Ізғ·дёәеҺҹж–ҷеҲ¶еҸ–ж°ўж°”жҳҜе·ҘдёҡдёҠеёёз”Ёзҡ„еҲ¶ж°ўж–№жі•гҖӮе·ІзҹҘпјҡ
CH4 (g)+H2O(g)=CO(g)+3H2(g)в–іH=+206.2 kJ/mo1
CH4(g)+CO2 (g)=2CO(g)+2H2 (g)в–і H=+247.4kJ/mo1
CH4 (g)дёҺH2O(g)еҸҚеә”з”ҹжҲҗCO2(g)е’ҢH2(g)зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸдёәгҖӮ

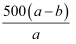 %
C . еҺҹдёҚйҘұе’Ңжә¶ж¶ІдёӯNaNO3зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә
%
C . еҺҹдёҚйҘұе’Ңжә¶ж¶ІдёӯNaNO3зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә 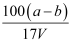 mol/L
D . еҺҹдёҚйҘұе’Ңжә¶ж¶Ізҡ„еҜҶеәҰдёә
mol/L
D . еҺҹдёҚйҘұе’Ңжә¶ж¶Ізҡ„еҜҶеәҰдёә 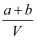 g/mL
g/mL
 зҡ„зӣҗй…ёж»ҙе…Ҙзӣӣжңү
зҡ„зӣҗй…ёж»ҙе…Ҙзӣӣжңү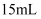 зЁҖж°Ёж°ҙе’Ң3ж»ҙз”Іеҹәж©ҷзҡ„й”ҘеҪўз“¶дёӯжөӢе®ҡе…¶жө“еәҰпјҢеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
зЁҖж°Ёж°ҙе’Ң3ж»ҙз”Іеҹәж©ҷзҡ„й”ҘеҪўз“¶дёӯжөӢе®ҡе…¶жө“еәҰпјҢеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү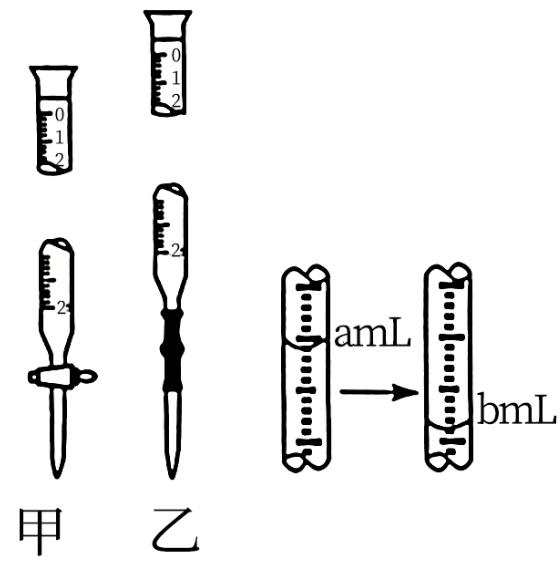
в‘ иӣӢзҷҪиҙЁзҡ„еҸҳжҖ§в‘ЎиӣӢзҷҪиҙЁзҡ„зӣҗжһҗв‘ўиғ¶дҪ“иҒҡжІү
в‘Јзӣҗзұ»ж°ҙи§Јв‘Өз„°иүІеҸҚеә”в‘Ҙж°§еҢ–иҝҳеҺҹеҸҚеә”
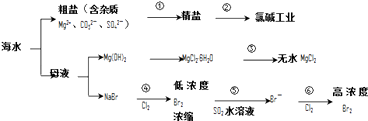
е·ІзҹҘпјҡMgCl2вҖў6H2OеҸ—зғӯз”ҹжҲҗMgпјҲOHпјүClе’ҢHClж°”дҪ“зӯүпјҺ
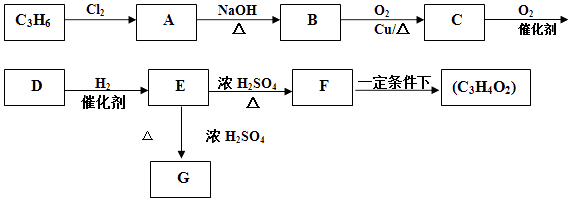
е·ІзҹҘпјҡFзҡ„еҲҶеӯҗејҸдёәC3H4O2пјӣжңүжңәзү©Gзҡ„еҲҶеӯҗејҸдёәC6H8O4 пјҢ еҗ«жңүдёҖдёӘе…ӯе…ғзҺҜпјҺ
-
пјҲ1пјү Eдёӯеҗ«ж°§е®ҳиғҪеӣўзҡ„еҗҚз§°жҳҜпјҺ
-
пјҲ2пјү BвҶ’Cзҡ„еҸҚеә”зұ»еһӢжҳҜпјӣEвҶ’Fзҡ„еҸҚеә”зұ»еһӢжҳҜпјҺ
-
пјҲ3пјү жңүжңәзү©Cзҡ„з»“жһ„з®ҖејҸдёәпјҺ
-
пјҲ4пјү з”ұFеҗҲжҲҗй«ҳиҒҡзү©пјҲC3H4O2пјүnзҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјӣз”ұEеҗҲжҲҗGзҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҺ
еҸҚеә”3FeпјҲsпјү+4H2OпјҲgпјү=Fe3O4пјҲsпјү+4H2пјҲgпјүпјҢеңЁдёҖеҸҜеҸҳзҡ„е®№з§Ҝзҡ„еҜҶй—ӯе®№еҷЁдёӯиҝӣиЎҢпјҢиҜ•еӣһзӯ”пјҡ
пјҲ1пјүеўһFeзҡ„йҮҸпјҢе…¶жӯЈеҸҚеә”йҖҹзҺҮзҡ„еҸҳеҢ–жҳҜ_______пјҲеЎ«еўһеӨ§гҖҒдёҚеҸҳгҖҒеҮҸе°ҸпјҢд»ҘдёӢзӣёеҗҢпјүгҖӮ
пјҲ2пјүе°Ҷе®№еҷЁзҡ„дҪ“з§Ҝзј©е°ҸдёҖеҚҠпјҢе…¶жӯЈеҸҚеә”йҖҹзҺҮ__________пјҢйҖҶеҸҚеә”йҖҹзҺҮ___________пјҲеЎ«еўһеӨ§гҖҒеҮҸе°ҸгҖҒдёҚеҸҳпјҢд»ҘдёӢзӣёеҗҢпјүгҖӮ
пјҲ3пјүдҝқжҢҒдҪ“з§ҜдёҚеҸҳпјҢе……е…Ҙж°Ұж°”дҪҝдҪ“зі»еҺӢејәеўһеӨ§пјҢе…¶жӯЈеҸҚеә”йҖҹзҺҮ___________пјҢйҖҶеҸҚеә”___________гҖӮ
пјҲ4пјүдҝқжҢҒеҺӢејәдёҚеҸҳпјҢе……е…Ҙж°Ұж°”дҪҝе®№еҷЁзҡ„дҪ“з§ҜеўһеӨ§пјҢе…¶жӯЈеҸҚеә”йҖҹзҺҮ__________гҖӮ
еңЁе®Өжё©дёӢпјҢдёӢеҲ—дә”з§Қжә¶ж¶Іпјҡ
в‘ 0.1 mol/L NH4ClВ в‘Ў0.1 mol/L CH3COONH4 В В В В В В в‘ў0.1 mol/L NH4HSO4 в‘Ј0.1 mol/L NH3В·H2Oе’Ң0.1 mol/L NH4Clж··еҗҲж¶ІВ В в‘Ө0.1 mol/L NH3В·H2OпјҢиҜ·ж №жҚ®иҰҒжұӮеЎ«еҶҷдёӢеҲ—з©әзҷҪпјҡ
пјҲ1пјүжә¶ж¶Ів‘ е‘Ҳ______жҖ§(еЎ«вҖңй…ёвҖқвҖңзўұвҖқжҲ–вҖңдёӯвҖқ)пјҢе…¶еҺҹеӣ жҳҜ_____________(з”ЁзҰ»еӯҗж–№зЁӢејҸиЎЁзӨә)
пјҲ2пјүеңЁжә¶ж¶Ів‘Јдёӯ______зҰ»еӯҗзҡ„жө“еәҰдёә0.1mol/LпјӣNH3В·H2Oе’Ң_____зҰ»еӯҗзҡ„йҮҸжө“еәҰд№Ӣе’Ңдёә0.2mol/LгҖӮ
пјҲ3пјүе®Өжё©дёӢпјҢжөӢеҫ—жә¶ж¶Ів‘Ўзҡ„pHпјқ7пјҢеҲҷиҜҙжҳҺCH3COO-зҡ„ж°ҙи§ЈзЁӢеәҰ_______(еЎ«вҖң>вҖқвҖң<вҖқжҲ–вҖңпјқвҖқ)NH4+зҡ„ж°ҙи§ЈзЁӢеәҰпјҢCH3COO-дёҺNH4+жө“еәҰзҡ„еӨ§е°Ҹе…ізі»жҳҜпјҡc(CH3COO-)______c(NH4+)
пјҲ4пјүеёёжё©дёӢпјҢжҹҗж°ҙжә¶ж¶ІMдёӯеӯҳеңЁзҡ„зҰ»еӯҗжңүпјҡNa+гҖҒA2-гҖҒHA-гҖҒH+гҖҒOH-пјҢеӯҳеңЁзҡ„еҲҶеӯҗжңүH2OгҖҒH2AгҖӮВ В
в‘ еҶҷеҮәй…ёH2Aзҡ„з”өзҰ»ж–№зЁӢејҸ________гҖӮ
в‘ЎиӢҘжә¶ж¶ІMз”ұ10mL 2molВ·L-1NaHAжә¶ж¶ІдёҺ2molВ·L-1NaOHжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲиҖҢеҫ—пјҢеҲҷжә¶ж¶ІMзҡ„pH________7(еЎ«вҖң>вҖқгҖҒвҖң<вҖқжҲ–вҖңпјқвҖқ)гҖӮ
пјҲ5пјүе·ІзҹҘпјҡеңЁе®Өжё©зҡ„жқЎд»¶дёӢпјҢpHеқҮдёә5зҡ„H2SO4жә¶ж¶Іе’ҢNH4Clжә¶ж¶ІгҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
в‘ дёӨжә¶ж¶ІдёӯпјҢc(H+)В·c(OH-)пјқ__________гҖӮ
в‘Ўеҗ„еҸ–5mLдёҠиҝ°жә¶ж¶ІпјҢеҲҶеҲ«еҠ ж°ҙзЁҖйҮҠиҮі50mLпјҢpHиҫғеӨ§зҡ„жҳҜ________жә¶ж¶ІгҖӮ
в‘ўеҗ„еҸ–5mLдёҠиҝ°жә¶ж¶ІпјҢеҲҶеҲ«еҠ зғӯеҲ°90в„ғпјҢpHиҫғе°Ҹзҡ„жҳҜ__________жә¶ж¶ІгҖӮ
в‘ЈH2SO4е’ҢNH4ClдёӨжә¶ж¶ІдёӯпјҢз”ұж°ҙз”өзҰ»еҮәзҡ„c(HпјӢ)еҲҶеҲ«дёә__________гҖҒ____________гҖӮ
е®Өжё©дёӢпјҢдёӢеҲ—еҗ„з»„зҰ»еӯҗеңЁжҢҮе®ҡжә¶ж¶ІдёӯиғҪеӨ§йҮҸе…ұеӯҳзҡ„жҳҜпјҲВ В пјү
В В В AпјҺ0.1 molВ·LвҲ’1 KI жә¶ж¶Іпјҡ Na+гҖҒK+гҖҒClOвҲ’ гҖҒOHвҲ’
В В В BпјҺ0.1 molВ·LвҲ’1 Fe2(SO4)3жә¶ж¶Іпјҡ Cu2+гҖҒNH4+ гҖҒNO3вҲ’гҖҒSO42вҲ’
В В В CпјҺ0.1 molВ·LвҲ’1 HCl жә¶ж¶Іпјҡ Ba2+гҖҒK+гҖҒCH3COOвҲ’гҖҒNO3вҲ’
В В В DпјҺ0.1 molВ·LвҲ’1 NaOHжә¶ж¶Іпјҡ Mg2+гҖҒNa+гҖҒSO42вҲ’гҖҒHCO3вҲ’
В В В В
зҺ°жңүдёӢеҲ—еҢ–еҗҲзү©пјҡ
AпјҺCH3CH2CH2CHOдёҺ![]()
![]()
BпјҺ![]()
![]() дёҺ
дёҺ![]()
![]()
CпјҺ![]()
![]() дёҺ
дёҺ![]()
![]()
DпјҺCH3CH2CвүЎCHдёҺCH2пјқCHпјҚCHпјқCH2
EпјҺ![]()
![]() дёҺ
дёҺ![]()
![]()
FпјҺжҲҠзғҜе’ҢзҺҜжҲҠзғ·
пјҲ1пјүеұһдәҺеҗҢзі»зү©зҡ„жҳҜВ В В В В В В В В В пјҢеұһдәҺеҗҢеҲҶејӮжһ„дҪ“зҡ„жҳҜВ В В В В В В В В В пјҲеЎ«зј–еҸ·пјүгҖӮ
пјҲ2пјүж №жҚ®е®ҳиғҪеӣўзҡ„зү№зӮ№еҸҜе°ҶCдёӯдёӨеҢ–еҗҲзү©еҲ’еҲҶдёәВ В В В В В В В В В В В В зұ»е’ҢВ В В В В В В В В В В В В зұ»гҖӮ
пјҲ3пјүе·ІзҹҘдёҚйҘұе’ҢзғҜзғғеҸҜиў«й…ёжҖ§й«ҳй”°й…ёй’ҫжә¶ж¶Іж°§еҢ–пјҢ其规еҫӢдёәпјҡ
![]()
![]()
иӢҘе°ҶAдёӯдёӨеҢ–еҗҲзү©зңӢдҪңжҳҜжҹҗеҚ•зғҜзғғиў«й…ёжҖ§й«ҳй”°й…ёй’ҫжә¶ж¶Іж°§еҢ–жүҖз”ҹжҲҗзҡ„пјҢеҲҷиҜҘеҚ•зғҜзғғзҡ„з»“жһ„з®ҖејҸдёәВ В В В В В В В В В гҖӮ
пјҲ4пјүеҶҷеҮәDдёӯдёӨзү©иҙЁзҡ„еҗҚз§°В В В В В В В В В В гҖҒВ В В В В В В В В В гҖӮ
В еёёжё©дёӢпјҢдёӢеҲ—еҗ„з»„зҰ»еӯҗеңЁеҲ¶е®ҡжә¶ж¶ІдёӯдёҖе®ҡиғҪеӨ§йҮҸе…ұеӯҳзҡ„жҳҜ
В В A.0.1 molВ·LпјҚ1зҡ„NaOHжә¶ж¶ІпјҡKпјӢгҖҒNaпјӢгҖҒSO42пјҚгҖҒCO32пјҚ
В В B.0.1 molВ·LпјҚ1зҡ„Na2CO3жә¶ж¶ІпјҡKпјӢгҖҒBa2пјӢгҖҒNO3пјҚгҖҒClпјҚ
В В C.0.1 molВ·LпјҚ1FeCl3жә¶ж¶ІпјҡKпјӢгҖҒNH4пјӢгҖҒIпјҚгҖҒSCNпјҚ
В В D.c(HпјӢ)/c(OHпјҚ)=1Г—1014зҡ„жә¶ж¶ІпјҡCa2пјӢгҖҒNaпјӢгҖҒClOпјҚгҖҒNO3пјҚ



