高中 化学
 3C(g)+nD(g),开始时A为4mol,B为6mol,5min末时测得C的物质的量为3mol,用D表示的化学反应速率
3C(g)+nD(g),开始时A为4mol,B为6mol,5min末时测得C的物质的量为3mol,用D表示的化学反应速率 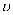 (D)为0.2mol/(L·min)。
(D)为0.2mol/(L·min)。 计算:
-
(1) 5min末A的物质的量浓度为;
-
(2) 前5min内用B表示的化学反应速率
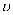 (B)为;
(B)为;
-
(3) 化学方程式中n值为。


-
(1) 写出仪器A、C、E的名称
-
(2) 分离以下混合物应该主要选用什么仪器?(填字母符号)
食用油和酒精: 汽油和水:.
-
(1) .
-
(2) .
-
(3) .
-
(4) .
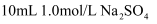 溶液加水稀释至
溶液加水稀释至 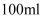 ,稀释后
,稀释后  的物质的量浓度为( )
的物质的量浓度为( )
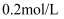 B .
B . 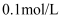 C .
C . 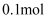 D .
D . 

-
(1) 试管中发生反应的化学方程式是。
-
(2) 请将方框中的收集装置补充完整。
-
(3) 将蘸有浓盐酸的棉球放在玻璃片上,再将集满NH3的集气瓶扣住棉球,可观察到的现象是。
-
(4) 将如图滴管中的水挤入烧瓶中,打开止水夹。

①可以观察到的现象是。
②通过该实验可以得到的结论有。
-
(5) NH3可以转化为其他含氮物质,如图为NH3转化为HNO3的流程。

①写出NH3与O2反应转化为NO的化学方程式。
②NH3转化为HNO3的整个过程中,为提高氮原子的利用率,可采取的措施是。
铁有 价和
价两种价态,下列有关反应不涉及铁元素价态变化的是 ( )
A . 用铁粉除去氯化亚铁溶液中的少许氯化铁杂质
B . 铁在氧气中燃烧,其产物溶于盐酸中可得到两种盐
C . 氢氧化亚铁是白色固体,在空气中迅速变成灰绿色,最终变成红褐色
D . 氢氧化铁受热分解
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
⑴ 煤的气化的主要化学反应方程式为:___________________________。
⑵ 煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________________________________。
⑶ 利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g) ![]() CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g) ![]() CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g) ![]() CH3OCH3(g) + CO2 (g)的ΔH= ___________;
CH3OCH3(g) + CO2 (g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
⑷ 已知反应②2CH3OH(g) ![]() CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
4.9g磷酸中含有 molH原子, 个O原子,与 克P2O5中所含P原子数相等。
某有机物,当它含有下列的一种官能团时,既能发生取代反应、氧化反应、酯化反应,又能发生消去反应的是( )

下列说法中正确的是( )
A.自然界中不存在游离态的硫
B.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
C.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
D.浓硫酸可用来干燥SO2、CO、Cl2等气体
探究苯与溴反应生成溴苯的实验可用如图所示装置,分析装置并完成下列题目:

(1)关闭止水夹F,打开止水夹C,由A口向装有少量苯的三口烧瓶中加入过量液溴,再加入少量铁屑,塞住A口,则三口烧瓶中发生反应的有机化学方程式为______________________。
(2)D、E试管内出现的现象分别为:D.______, E.__________。
(3)待三口烧瓶中的反应进行到仍有气泡冒出时,松开止水夹F,关闭止水夹C,可以看到的现象是___________。
某气态烃在密闭容器内与氧气混合完全燃烧,如果燃烧前后容器内(温度高于1000C)压强保持不变,该烃可能是( )
A C2H6 B C2H4 C C3H8 D C3H6
(I)工业上常用电解饱和食盐水的方法制备氯气,其装置如右图所示:
 (1)写出电解饱和食盐水的化学方程式并在化学方程式上标出电子转移的方向和数目: 。
(1)写出电解饱和食盐水的化学方程式并在化学方程式上标出电子转移的方向和数目: 。
(2)电解时,将Y极(阳极)生成的物质通入盛有NaI溶液的试管中,再加入四氯化碳充分振荡,最后观察到的现象是 。
A.溶液分层,上层无色,下层橙红色
B.溶液分层,上层橙红色,下层无层
C.溶液分层,上层无色,下层紫红色
D.溶液分层,上层紫红色,下层无层
(3)用氯气制备漂白粉,请写出漂白粉长期露置在空气中失效的反应的化学方程式 ; 。
 (II)某同学对实验室制取氯气的装置进行改进,设计了制取无水氯化铁的实验装置图(如下),将浓盐酸滴加到盛有二氧化锰粉末的圆底烧瓶中。请回答下列问题:
(II)某同学对实验室制取氯气的装置进行改进,设计了制取无水氯化铁的实验装置图(如下),将浓盐酸滴加到盛有二氧化锰粉末的圆底烧瓶中。请回答下列问题:
(4)烧瓶中发生反应的化学方程式 ;
(5)产生的气体通过B、C装置,可以得到干燥纯净的氯气,B瓶中的试剂是 ;
(6)如果将过量二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要原因为 。
(7)玻璃管D中反应现象是 ;写出反应方程式 。
(8)干燥管E中盛有碱石灰(CaO+NaOH),其作用是 。
下列有关实验的叙述中,合理的是
①用pH试纸测得氯水的pH为2
②用瓷坩埚高温熔融Na2CO3固体
③用纸层析法分离Fe3+、Cu2+时,氨熏显色后上方出现棕色斑点,下方出现蓝色斑点
④做过酚醛树脂实验的试管,用氢氧化钠溶液浸洗
⑤用NaOH一种试剂可以鉴别分别含Na+、Mg2+、Al3+、Fe2+、Fe3+、NH4+的溶液
⑥向沸腾的氢氧化钠溶液中滴加饱和氯化铁溶液制备氢氧化铁胶体
A. ②④⑥ B. ③⑤ C. ①②④ D. ②③④⑤⑥
己知在碱性溶液中可发生如下反应:2R(OH)3+3C1O-+4OH-=2RO4n-+3Cl-+5H2O。则 RO4n-中 R 的化合价是
A. +7 B. +6 C. +5 D. +4
氢氧燃料电池以石墨碳棒为电极,以硫酸溶液为电解质溶液,下列叙述正确的是
A.正极反应式为:O2+4e-+2H2O =4OH-
B.工作一段时间后,电解液中硫酸的物质的量浓度不变
C.通氢气的电极上发生还原反应
D.溶液中氢离子流向通氧气的电极



