2019-2020年高一上册第二次月考化学免费试卷(安徽省怀宁中学)
| 1. 选择题 | 详细信息 |
|
下列各组物质,按单质、化合物、混合物顺序排列的是 A. 氯水、生石灰、漂白粉 B. 液氯、烧碱、氨水 C. 生铁、氢氧化铁胶体、空气 D. 氮气、盐酸、胆矾 |
|
| 2. 选择题 | 详细信息 |
|
Fe(OH)3 胶体和 MgCl2 溶液共同具有的性质是 A.都是无色透明的溶液 B.分散质粒子都可通过滤纸 C.加入盐酸后都无明显现象 D.都有丁达尔效应 |
|
| 3. 选择题 | 详细信息 |
|
下列化学反应中电子转移的表示方法正确的是 A.  B. C.  D. 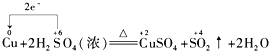 |
|
| 4. 选择题 | 详细信息 |
|
下图是分离混合物时常用的仪器,可以进行的混合物分离操作分别是( ) A.蒸馏、过滤、萃取、蒸发 B.蒸馏、蒸发、萃取、过滤 C.萃取、过滤、蒸馏、蒸发 D.过滤、蒸发、萃取、蒸馏 |
|
| 5. 选择题 | 详细信息 |
|
下列说法不正确的是( ) A.“抗坏血酸”维生素C具有还原性 B.杨万里《戏笔》中写道“野菊荒苔各铸钱,金黄铜绿两争妍”,铜绿的主要成分为碱式碳酸铜, Cu2(OH)2CO3属于碱式盐 C.向碳酸钠溶液中滴加稀盐酸,先不冒气泡,后冒气泡 D.食物腐败、钟乳石的形成、植物光合作用都与氧化还原反应有关 |
|
| 6. 选择题 | 详细信息 |
|
已知在稀硝酸中加入铝粉不产生氢气。若在加入铝粉能放出氢气的无色溶液中,分别加入下列各组、离子,则可能大量共存的是( ) A. Ca2+、NO3-、CO32-、Na+ B. Na+、Ba2+、Mg2+、HCO3- C. NO3-、Cu2+、K+、Cl- D. NO3-、K+、AlO2-、OH- |
|
| 7. 选择题 | 详细信息 |
|
下列除去杂质方法正确的是( ) A. 除去CO2中混有的CO:用浓NaOH溶液洗气 B. 除去BaCO3固体中混有的BaSO4:加过量稀盐酸后,过滤、洗涤 C. 除去KNO3溶液中混有的NaCl:蒸发结晶 D. 除去Cu粉中混有的CuO:加适量稀硫酸后,过滤、洗涤 |
|
| 8. 选择题 | 详细信息 |
|
在相同条件下,2mLX(气)跟5mLC2(气)恰好完全反应,生成4mLAC2(气)与2mLB2C(气),则X的分子式是( ) A. AB B. B2C C. A2B2 D. BC2 |
|
| 9. 选择题 | 详细信息 |
|
标准状况下VLNH3含有a个原子,则阿伏加德罗常数是( ) A. 5.6a/V mol-1 B. 22.4a/V mol-1 C. 22.4a mol- D. 11.2 a/v mol-1 |
|
| 10. 选择题 | 详细信息 |
|
根据下列各反应,判断有关物质还原性由强到弱的顺序是( ) ①H2SO3 + I2 + H2O = 2HI + H2SO4 ②2FeCl3 + 2HI = 2FeCl2 + 2HCl + I2 ③3FeCl2 + 4HNO3 = 2FeCl3 + NO↑ + 2H2O + Fe(NO3)3 A. H2SO3>HI>FeCl2>NO B. NO>FeCl2>H2SO3>HI C. I2>FeCl2>H2SO3>NO D. FeCl2>HI>H2SO3>NO |
|
| 11. 选择题 | 详细信息 |
|
在标准状况下,m g气体A与n g气体B的分子数相同,下列说法中不正确的是 A. 两种气体A与B的相对分子质量之比为m∶n B. 同质量气体A与B的分子数之比为n∶m C. 同温同压下,A、B两气体的密度之比为n∶m D. 相同状况下,同体积A、B两气体的质量之比为m∶n |
|
| 12. 选择题 | 详细信息 |
|
下列离子方程式正确的是( ) A. 向Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2OH-+2HCO3-═ CaCO3↓+CO32-+2H2O B. 向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3+ + 4NH3·H2O ═ AlO2-+ 4NH4+ + 2H2O C. 1mol•L﹣1的NaAlO2溶液和2.5mol•L﹣1的HCl溶液等体积互相均匀混合:2AlO2-+5H+═ Al3++Al(OH)3↓+H2O D. 醋酸除去水垢:2H+ + CaCO3 ═ Ca2+ + CO2↑+ H2O |
|
| 13. 选择题 | 详细信息 |
|
下列说法中正确的是( ) A. 标准状况下,22.4L水中所含的分子数约为6.02×1023 B. 标准状况下,aL的氧气和氮气的混合物含有的分子数约为 C. 常温常压下,48g O3气体含有的氧原子数为6.02×1023 D. 2.24L CO2中含有的原子数为0.3×6.02×1023 |
|
| 14. 选择题 | 详细信息 |
|
混合气体由N2和CH4组成,同温同压下,测得混合气体相对于氢气的密度是9.2,则混合气体中N2和CH4的质量比为 A.7:16 B.1:4 C.4:1 D.1:2 |
|
| 15. 选择题 | 详细信息 |
|
点燃黑火药在发生爆炸时发生如下反应2KNO3+3C+S===K2S+N2 ↑+3CO2↑,下列说法正确的是 A. KNO3是氧化剂,C 和S是还原剂 B. 产生22.4L气体,转移电子的物质的量为3mol C. N2和CO2都是氧化产物 D. 单质碳发生氧化反应 |
|
| 16. 选择题 | 详细信息 |
|
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶解于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。正确的是( ) A.①④②⑤①③ B.①④⑤②①③ C.①②⑤④①③ D.①②④⑤①③ |
|
| 17. 选择题 | 详细信息 |
下列实验过程中产生沉淀的物质的量(Y)与加入试剂的物质的量(X)之间的关系正确的是( ) A. 甲向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡 B. 乙向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡 C. 丙向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量 D. 丁向NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入CO2至过量 |
|
| 18. 选择题 | 详细信息 |
|
24 mL 0.05 mol·L-1的 Na2SO3溶液恰好与20 mL 0.02 mol·L-1的K2R2O7的溶液完全反应,则R元素在还原产物中的化合价为 A. 0 B. +2 C. +3 D. +6 |
|
| 19. 选择题 | 详细信息 |
|
取3.5 g某二价金属的单质投入50 g溶质质量分数为18.25%的稀盐酸中,反应结束后,金属仍有剩余;若取2.5 g该金属投入相同质量、相同质量分数的稀盐酸中,等反应结束后,加入该金属还可以反应。该金属的相对原子质量为 ( ) A. 24 B. 40 C. 56 D. 65 |
|
| 20. 选择题 | 详细信息 |
|
向 1L 1mol/L AlCl3 溶液中滴加一定量的 NaOH溶液,若产生沉淀为 0.8mol,则消耗的 NaOH的物质的量可能是 A.0.8 mol B.2.8 mol C.3.0 mol D.3.2 mol |
|
| 21. 计算题 | 详细信息 |
|
(1)顺铂(化学名称为顺二氯二氨合铂(II),化学式为PtCl2(NH3)2,相对分子质量为:300)是一种用于治疗癌症的药物,一片顺铂药片所含顺铂的质量为6×10-4g,那么一片顺铂药片中N原子的物质的量___mol; (2)乙烯气体(C2H4)是石油化工产品之一,也是最重要的有机化工基础原料之一,在标准状况下其密度为___g•L-1; (3)现有一种矿泉水样品,1.0L的该矿泉水含有4.8×10-2gMg2+,则___L矿泉水中含有1mol Mg2+; (4)某“84消毒液”1000mL,其有效成分为NaClO(式量:74.5),质量分数为14.9%,密度为1.2g/mL,其溶质的物质的量浓度为___mol•L﹣1; (5)已知CO和CO2的混合气体7.2g,在标准状况下所占的体积为4.48L。则该混合气体中氧元素的质量为___g; |
|
| 22. 实验题 | 详细信息 | ||||||||||||||||||||||||
下表是生活生产中常见的物质,表中列出了它们的(主要)成分
|
|||||||||||||||||||||||||
| 23. 填空题 | 详细信息 |
|
钒具有众多优良的性能,用途十分广泛,有金属“维生素”之称。完成下列填空: (1)将废钒催化剂(主要成分 V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性,溶液中含 VO2+、K+、SO42-等离子。写出该反应的化学方程式:____________。 (2)向上述所得溶液中加入 KClO3 溶液,充分反应后,溶液中新增加了 VO2+、Cl-。写出并配平该反应的离子方程式,并标出电子转移的数目和方向_____。 (3)已知V2O5 能和盐酸反应生成氯气和VO2+,请再写一个离子方程式:________,说明还原性:SO32->Cl->VO2+。 |
|
| 24. 推断题 | 详细信息 |
|
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现分别取100 mL的两等份溶液进行如下实验: ①第一份加过量NaOH溶液后加热,收集到0.02 mol气体,无沉淀生成,同时得到溶液甲。 ②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、干燥、灼烧后,得到1.02 g固体。 ③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65 g固体。 依据实验回答下列问题: (1)由①可知一定存在的离子为_______,其浓度为_______mol·L-1。 (2)写出②中产生沉淀的离子方程式_______。 (3)由③可知一定存在的离子为_______,其浓度为_______mol·L-1。 (4)综合上面三个实验,该混合物的水溶液中一定不存在的离子是_______(填离子符号)。 (5)某同学通过分析认为该溶液中一定存在K+,他的理由是_______。 |
|
| 25. 填空题 | 详细信息 |
|
某课外活动小组收集了一种合金进行以下探究(已知铜元素的焰色反应呈绿色)。 (1)外观暗灰色,表皮光滑; (2)在酒精灯外焰上灼烧,火焰呈绿色,合金片熔化,但不滴落; (3)取刮去表皮的合金10 g,放入足量的稀硫酸中,收集到标准状况下的H2 8.96 L; (4)另取刮去表皮的合金10 g,放入足量的NaOH溶液中,也收集到标准状况下的H2 8.96 L。 试据此判断,该合金中一定含有的元素是________(写元素符号);可能含有的元素是________(填选项编号)。 a.Ag b.Mg c.Na d.Fe 如果该合金中只含2种元素,则二者的质量比是________。 |
|





