湖南省常德市芷兰实验中学2020-2021年高二上册第二次月考化学题带答案和解析
| 1. 选择题 | 详细信息 |
|
下列各组物质中,互为同系物的是 ( ) A. C.CH2=CH2和CH2=CH—CH=CH2 D.甲醇与乙二醇 |
|
| 2. 选择题 | 详细信息 |
柠檬烯是一种天然的功能单萜,在食品中作为香料添加剂被广泛使用,其结构简式如图,下列有关柠檬烯的分析正确的是 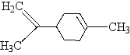 A.分子中所有碳原子可能在同一平面上 B.和丁基苯( C.—定条件下,可以发生加成反应、取代反应、氧化反应、加聚反应 D.1 mol柠檬烯最多可与 1 mol Br2 反应 |
|
| 3. 选择题 | 详细信息 | ||||||||||||||||||||
鉴别下列各组有机物所用试剂及现象均正确的是( )
A.A B.B C.C D.D |
|||||||||||||||||||||
| 4. 选择题 | 详细信息 |
|
下列关于有机物的说法中,正确的一组是( ) ①淀粉、油脂在一定条件下都能发生水解反应 ②淀粉和纤维素互为同分异构体 ③食用油属于酯类,石蜡油属于烃类 ④石油的分馏和煤的气化都是发生了化学变化 ⑤淀粉遇碘变蓝色,在加热条件下葡萄糖能与新制Cu(OH)2悬浊液发生反应 A.①②⑤ B.①②④ C.①③⑤ D.③④⑤ |
|
| 5. 选择题 | 详细信息 |
|
维通橡胶是一种耐腐蚀、耐油、耐高温、耐寒性能都特别好的氟橡胶。它的结构简式为 A.CF2=CF2和CF3CF=CF2 B.CH2=CF2和CF3CF=CF2 C.CH2=CF-CF=CF-CF3 D.CH2=CF2-CF2=CF-CF3 |
|
| 6. 选择题 | 详细信息 |
|
反应C(s)+H2O(g) A.保持压强不变,充入N2使容器的体积增大 B.将容器的体积缩小一半 C.保持体积不变,充入H2O(g) D.增加C的量 |
|
| 7. 选择题 | 详细信息 |
|
白磷和红磷互为同素异形体,它们都可以在氧气中燃烧,已知: ①P4(白磷,s)+5O2(g)=2P2O5(s) ∆H1; ②4P(红磷,s)+5O2(g)=2P2O5(s) ∆H2; ③P4(白磷,s)=4P(红磷,s) ∆H3=-29.2 kJ·mol-1。 下列有关说法正确的是( ) A.变化③为物理变化 B.∆H2>∆H1 C.∆H1>∆H2 D.白磷比红磷稳定 |
|
| 8. 选择题 | 详细信息 |
|
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应: A.x的值是3 B.开始时A的物质的量为2.8mol C.5min内,B的平均反应速率为0.04mol•L-1•min-1 D.5min时,容器中气体总的物质的量为3.6mol |
|
| 9. 选择题 | 详细信息 | |||||||||||||||
下列生产或实验事实引出的相应结论错误的是( )
|
||||||||||||||||
| 10. 选择题 | 详细信息 |
|
中和热测定实验中,用 A.用量筒量取盐酸时仰视取液,测得的中和热 B.装置中的大小烧杯之闻填满碎泡沫塑料的作用是保温隔热减少热量损失 C.酸碱混合时,量筒中 D.改用 |
|
| 11. 选择题 | 详细信息 |
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得,下列有关叙述正确的是( ) A. 根据有机物的分类,贝诺酯属于芳香烃,分子式为 B. 乙酰水杨酸和对乙酰氨基酚均能与 C. 乙酰水杨酸和对乙酰氨基酚可用 D. 1mol乙酰水杨酸最多能与2molNaOH发生反应 |
|
| 12. 选择题 | 详细信息 |
连接4个不同原子或原子团的碳原子叫手性碳原子。厚朴酚是一种常见中药的主要成分之一,有抗菌、消炎等功效,其结构简式如图a所示。下列说法错误的是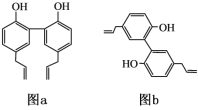 A.厚朴酚与溴水既可发生加成反应又可发生取代反应 B.图b所示为厚朴酚的一种同分异构体 C.厚朴酚分子中含有手性碳原子 D.厚朴酚分子中所有碳原子可能共平面 |
|
| 13. 选择题 | 详细信息 |
|
(双选)下列关于烯烃、炔烃的叙述中,正确的是( ) A. 某物质的名称为2—乙基—1—丁烯,它的结构简式为 B. CH3—CH===CH—C≡C—CF3分子结构中最多有4个碳原子在一条直线上 C. 相同物质的量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的量相同 D. β月桂烯的结构如图 |
|
| 14. 选择题 | 详细信息 |
香豆素类化合物具有抗病毒、抗癌等多种生物活性,香豆素﹣3﹣羧酸可由水杨醛制备.下列说法正确的是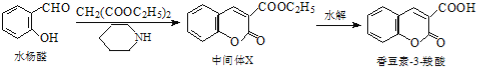 A.水杨醛分子中所有原子可能处于同一平面上 B.中间体X易溶于水 C.香豆素﹣3﹣羧酸能使酸性高锰酸钾溶液褪色 D.lmol水杨醛最多能与3 molH2发生加成反应 |
|
| 15. 选择题 | 详细信息 |
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是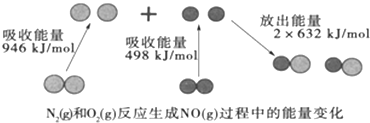 A. 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ B. NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 C. 在1 L的容器中发生反应,10 min内 N2减少了1 mol,因此10 min内的平均反应速率为v(NO)=0.1 mol· D. 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 |
|
| 16. 选择题 | 详细信息 |
|
火箭推进器常以联氨(N2H4) 为燃料、过氧化氢为助燃剂.已知下列各物质反应的热化学方程式: N2H4(g)+O2(g)=N2(g)+2H2O(g)△H1=﹣533.23kJ•mol﹣1;H2O(g)=H2O (l)△H2=﹣44kJ•mol﹣1;2H2O2(l)=2H2O(l)+O2(g)△H3=﹣196.4kJ•mol﹣1则联氨与过氧化氢反应的热化学方程式可表示为( ) A.N2H4(g)+2H2O2(l)═N2(g)+4H2O(l)△H=+817.63 kJ•mol﹣1 B.N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣641.63 kJ•mol﹣1 C.N2H4(g)+2H2O2(l)═N2(g)+4H2O(l)△H=﹣641.63 kJ•mol﹣1 D.N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣817.63 kJ•mol﹣1 |
|
| 17. 填空题 | 详细信息 |
|
(1)结构简式为的 (2)1 mol壬烷C9H20完全燃烧生成二氧化碳和水,需消耗氧气_____mol。 (3) (4)CH3CH2CH2OH在铜作催化剂并加热的作用下与O2反应的化学方程式_____________________。 |
|
| 18. 填空题 | 详细信息 |
|
下列6种与生产、生活相关的有机化合物: ①HCHO(防腐剂) ② ④ (1)属于高分子的是_______(填序号)。 (2)与①互为同系物的是_______(填序号)。 (3)与③互为同分异构体的是_______(填序号)。 |
|
| 19. 填空题 | 详细信息 |
|
化学反应速率和限度是中学化学原理中很重要部分,根据所学知识回答下列问题: I.用纯净的锌粒与稀盐酸反应制取氢气气体,请回答: 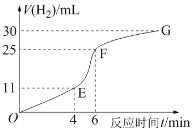 (1)实验过程如上图所示,分析判断_____段化学反应速率最快(填OE、EF或FG)。 (2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其原因是__________。 (3)为了减缓上述反应的速率,欲向溶液中加入下列物质少许,你认为可行的是_____。 A.硫酸铜溶液 B.水 C.浓盐酸 Ⅱ.某温度时,在2 L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如下图所示。由图中数据 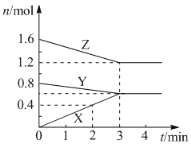 (1)该反应的化学方程式:____________________________; (2)反应开始至2 min末,X的反应速率为_______(mol·L﹣1·min﹣1); (3)反应前的压强与平衡时的压强之比为_____。 |
|
| 20. | 详细信息 |
化合物H是一种抗病毒药物,在实验室中利用芳香烃A制备H的流程如图所示(部分反应条件已略去):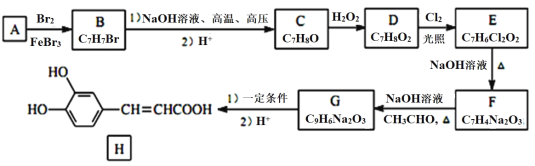 已知:①有机物B苯环上只有两种不同环境的氢原子; ②两个羟基连在同一碳上不稳定,易脱水形成羰基或醛基; ③RCHO+CH3CHO ④   (1)有机物B的名称为_________。 (2)由D生成E的反应类型为__________,E中官能团的名称为__________。 (3)由G生成H所需的“一定条件”为_____________。 (4)写出F (5)F酸化后可得R,X是R的同分异构体,X能发生银镜反应,与氯化铁溶液作用显紫色,且其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为1:2:2:1,写出1种符合条件的X的结构简式:_________________。 (6)设计由 |
|
| 21. 计算题 | 详细信息 |
|
在最新的家用汽车的调查中发现,新车中气体的质量不符合标准。汽车污染主要来源于汽车配件及材料,它们都会产生大量的有毒有机物。其中一种有毒物质为A,为了测定有机物A的结构,做如下实验: ①将9.2g该有机物完全燃烧,生成标况下15.68L的CO2和7.2g水; ②用质谱仪测定其相对分子质量,得如图一所示的质谱图; 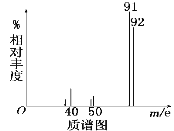 (1)则由图可知该分子的相对分子质量是___,有机物A的分子式为____。 (2)用核磁共振仪处理该化合物得到四个峰,且面积之比是1∶2∶2:3,则有机物的名称为___,其苯环上的一氯代物有___种。若将有机物A与氢气完全加成,则加成后的有机物的一氯代物共有___种。 |
|
| 22. 实验题 | 详细信息 | |||||||||||||||
实验室常用环己醇脱水合成环己烯。实验装置如图: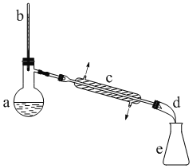 有关实验数据如 表:
合成反应:在a中加入20 g环己醇,冷却搅动下慢慢加入1mL浓硫酸。c中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.当烧瓶中只剩下很少量的残渣并出现阵阵白雾时停止蒸馏。 |
||||||||||||||||



