什邡中学高二化学下册月考试卷题带答案和解析
| 1. 选择题 | 详细信息 |
|
化学与生产、生活、社会密切相关。下列有关说法中正确的是 A.绚丽的烟花发光是添加了含钾、钠、铁、铜等金属元素的化合物 B.“天宫一号”使用的碳纤维是一种新型有机高分子材料 C.绿色荧光蛋白质 D.石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
|
| 2. 选择题 | 详细信息 |
|
化学与生产、生活密切相关。下列说法错误的是 A.泡沫灭火器可用于一般的起火,也适用于电器起火 B.绿色化学要求从源头上消除或减少生产活动对环境的污染 C.锅炉水垢中含有的 D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法 |
|
| 3. 选择题 | 详细信息 |
|
下列反应的离子方程式书写正确的是 A. 碳酸钙与足量浓硝酸反应:CaCO3+2H+ B. 氢氧化钠溶液与稀醋酸反应:OH-+H+ C. 氯化铝溶液与过量氨水反应: A13++3OH-=A1(OH)3↓ D. 钠与水反应:Na+2H2O |
|
| 4. 选择题 | 详细信息 |
|
下列说法错误的是 A. 0.1mol/L的Na2CO3溶液加适量水稀释后,溶液中 B. 若使Na2S溶液中 C. 25℃时,浓度均为0. 1mol/L NaOH和NH3·H2O混合溶液中c(OH- )>c(Na+ )=c(NH3·H2O) D. 0.2 mol/L CH3COOH溶液与0. 1mol/L NaOH溶液等体积混合:2c(H+)-2c(OH -)=c(CH3COO-)-c(CH3COOH) |
|
| 5. 选择题 | 详细信息 |
|
下列叙述正确的是( ) A. △H>0的化学反应一定不能自发进行 B. 反应2NO2(g) C. FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 D. Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s) |
|
| 6. 选择题 | 详细信息 |
某温度下气体反应达到化学平衡,平衡常数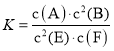 。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是 。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是A.恒容时,向容器中充入稀有气体,反应速率不变 B.增大c(A)、c(B),K增大 C.该反应的化学方程式为2E(g)+F(s)⇌A(g)+2B(g) D.正反应为放热反应 |
|
| 7. 选择题 | 详细信息 |
某华人科学家和他的团队研发出“纸电池” (如图)。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为: Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是 A.该电池的正极材料为锌 B.该电池反应中二氧化锰发生了氧化反应 C.电池的正极反应式为2MnO2 +2H2O+2e-= 2MnO(OH)+2OH- D.当有0.1mol锌溶解时,流经电解液的电子数为1.204×1023 |
|
| 8. 填空题 | 详细信息 |
铅蓄电池的充放电反应为Pb(s)+PbO2(s)+2H2SO4(aq) (1)将A接E、B接F,B电极出现_____________现象,电极反应式为_____________,说明F为正极。 (2)铅蓄电池工作时(放电),E电极的反应式为_____________,充电时该极与外接电源的_____________极相连。 (3)若有0.2mol电子发生转移,则正极消耗PbO2的物质的量是______mol。 (4)如图是在金属锌板上贴上一张用某溶液浸湿的滤纸。  ①若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现____色,铅笔芯c点处的电极反应式为________________。 ②若用KI-淀粉溶液浸湿滤纸,用导线将a、b与铅蓄电池的E、F电极相连,铅笔芯c点处出现蓝色,则b接的是_______(填“E”或“F”)电极。 |
|
| 9. 计算题 | 详细信息 |
|
联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4能放出大量的热。 (1)已知:2NO2(g)=N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)=N2O4(g) 达到平衡。其它条件不变时,下列措施: A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度 能提高NO2转化率的是_______(填字母)。 (2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O (l) ,放出19.14kJ 的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O (l)的△H=______kJ·mol-1。 (3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L-1、c(N2O4)=0.0120mol·L-1。计算反应2 NO2(g) (4)现用一定量的Cu 与足量的浓HNO3反应,制得1.00L已达平衡的N2O4和NO2 混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu的质量是________。 |
|
| 10. | 详细信息 |
金属钼在工业和国防建设中有重要的作用。钼(Mo)的常见化合价为+6、+5、+4。由钼精矿(主要成分是MoS2)可制备单质钼和钼酸钠晶体(Na2MoO4·2H2O),部分流程如图1所示: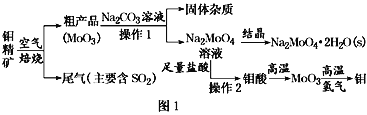 已知:钼酸微溶于水,可溶于液碱和氨水。 回答下列问题: (1)焙烧钼精矿时发生的化学方程式为_____________________________。 (2)钼精矿焙烧时排放的尾气对环境的主要危害是___________________,请提出一种实验室除去该尾气的方法____________________________________。 (3)操作2的名称为________。由钼酸得到MoO3所用到的硅酸盐材料仪器的名称是________。 (4)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。 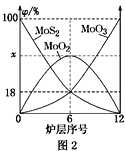 ①x=________。 ②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2的反应,若该反应转移6mol电子,则消耗的氧化剂的化学式及物质的量分别为________、________。 (5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中c(MoO42-)=0.80mol·L−1,c(SO42-)=0.04 mol·L−1,在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当BaMoO4开始沉淀时,SO42-的去除率是________。[Ksp(BaSO4)=1.1×10−10、Ksp(BaMoO4)=4.0×10−8,溶液体积变化可忽略不计] |
|
| 11. 实验题 | 详细信息 |
|
工业废弃物的资源化回收再利用,可以更大限度地发挥原材料的价值。某教师在指导学生做研究性学习时,拟利用废铁屑在实验室制备FeSO4溶液,再与等物质的量的(NH4)2SO4反应,制备补血剂硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O,相对分子质量为392]。硫酸亚铁铵晶体比一般亚铁盐稳定,在空气中不易被氧化,易溶于水,不溶于乙醇。 (1)废铁屑的净化:将废铁屑投入10%的碳酸钠溶液中并加热5~10min,通过倾析法弃去纯碱溶液,并用蒸馏水洗净废铁屑,待用。 (2)酸浸净化后的废铁屑:将2gFe粉、10mL3mol·L-1的H2SO4溶液加入烧瓶中反应,用如图所示装置制备FeSO4溶液。保持温度70~80℃,适当添加水以补充被蒸发掉的水分,并控制溶液的pH,至反应无明显气泡产生,停止加热,过滤,称量残留固体质量。  ①反应过程中会产生少量H2S、PH3等气体,需使用封闭装置。写出用CuSO4溶液吸收H2S气体的化学反应方程式:____________________________ ②反应过程中使用过量铁粉的目的是____________________________ (3)制备(NH4)2Fe(SO4)2·6H2O:向FeSO4溶液中加入一定质量的(NH4)2SO4固体,70~80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。 实验中,需对过滤出产品的母液(pH<1)进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是_____ (填序号)。 A.通入过量Cl2:Fe2+、H+、NH4+、Clˉ、SO42ˉ B.加入过量KSCN溶液:K+、NH4+、Fe3+、SO42ˉ、SCNˉ C.加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42ˉ、OHˉ D.加入过量NaClO和NaOH的混合溶液:Na+、SO42ˉ、Clˉ、ClOˉ、OHˉ (4)产品纯度测定:称取ag产品溶于水,配制成500mL溶液,取25.00mL待测液,用浓度为cmol·L-1的酸性KMnO4溶液滴定。重复上述操作2次实验结果如下:  该产品的纯度为____________________________(用含a、c的代数式表示)。 有同学提出,测定产品中SO42ˉ的含量也可测定产品的纯度,请补充完整实验方案:称取约0.4g样品,溶于70mL水,__________________________________________________,将沉淀移入坩埚,灼烧至恒重,记录数据(实验中必须使用的试剂有:2mol·L-1的HCl溶液、BaCl2溶液、AgNO3溶液)。 |
|
最近更新



