2018-2019年高一上期期末考试化学试卷带参考答案和解析(吉林省长春市第十一高中)
| 1. 选择题 | 详细信息 |
|
金属钠投入水中发生剧烈反应,并有氢气生成。装运金属钠的包装箱应贴的图标是 A.  B. B.  C. C.  D. D.  |
|
| 2. 选择题 | 详细信息 |
|
下列物质不属于合金的是( ) A. 黄铜 B. 青铜 C. 不锈钢 D. 水银 |
|
| 3. 选择题 | 详细信息 |
|
下列物质在氯气中燃烧,实验现象描述正确的是 A. Na——黄色的烟 B. H2——苍白色火焰 C. Cu——蓝色的烟 D. Fe——棕色的雾 |
|
| 4. 选择题 | 详细信息 |
|
下列叙述正确的是( ) A. 1 mol N2的质量为28 g/mol B. 标准状况下,1 mol任何物质的体积均为22.4L C. Cl2的摩尔质量为71 g D. 常温常压下,32 g SO2 的物质的量为0.5mol |
|
| 5. 选择题 | 详细信息 |
|
熔化氢氧化钠时,应选用的坩埚是( ) A. 铁坩埚 B. 石英坩埚 C. 刚玉坩埚 D. 陶瓷坩埚 |
|
| 6. 选择题 | 详细信息 |
|
下列有关物质颜色,正确的组合是( ) ①FeSO4•7H2O 棕黄色 ②Fe2O3 红棕色 ③Fe(OH)2 白色 ④Fe3O4 黑色 ⑤CuSO4•5H2O 白色 ⑥HCl 无色 A. ①②③④ B. ②③④⑥ C. ②③④⑤ D. ①②④⑥ |
|
| 7. 选择题 | 详细信息 |
|
分类法在化学学科的发展中起到了非常重要的作用。下列物质分类不合理的是( ) A. 酸性氧化物:CO2、SO2、SiO2 B. 碱性氧化物:Na2O2、MgO、CaO C. 电解质:BaSO4、KAl(SO4)2•12H2O、HCl D. 胶体:烟水晶、硅酸溶胶、云雾 |
|
| 8. 选择题 | 详细信息 |
|
下列各组离子能够大量共存的是( ) A. 加入Al粉后产生H2的溶液中:Na+、HCO3﹣、SO42﹣、Cl¯ B. 滴加石蕊试剂变红的溶液中:Na+、Fe2+、NO3﹣、Cl¯ C. 酸性溶液中:Fe3+、K+、SCN¯、SO42﹣ D. 澄清透明的溶液中:Cu2+、H+、NH4+、SO42﹣ |
|
| 9. 选择题 | 详细信息 |
|
下列关于硅及其化合物的说法中,正确的是( ) A. 硅可用于制造光导纤维 B. 水泥、玻璃、水晶饰物都是硅酸盐制品 C. 可用反应Na2SiO3+2HCl═2NaCl+H2SiO3(胶体)制取硅酸 D. SiO2既能与HF反应又能与强碱反应,所以SiO2是两性氧化物 |
|
| 10. 选择题 | 详细信息 |
|
下列关于氯水的说法正确的是( ) A. 新制氯水含有Cl2、HCl、HClO、H2O分子 B. 紫色石蕊试剂滴入新制氯水中,溶液先变红后变无色 C. 氯水和液氯都能使干燥的有色布条褪色 D. 新制氯水的pH值要比久置氯水的pH值小 |
|
| 11. 选择题 | 详细信息 |
下列装置及药品和实验室制备的气体相匹配的是: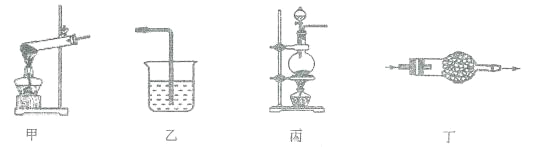 A. 甲装置用来制备氧气 B. 乙装置用来尾气处理氯化氢气体 C. 丙装置用来制取氯气 D. 丁装置中盛有碱石灰用来干燥二氧化碳气体 |
|
| 12. 选择题 | 详细信息 |
|
一定条件下,一种反应物过量,另一种反应物可以完全反应的是 A. 过量的水与氯气 B. 过量的氢氧化钠与二氧化硅 C. 过量的二氧化锰与浓盐酸 D. 过量的氨水与氢氧化铝 |
|
| 13. 选择题 | 详细信息 |
|
用漂白粉溶液浸泡过的有色布条,如晾晒在空气中,过一段时间,其漂白效果更好的原因是 A. 漂白粉被氧化 B. 漂白粉和二氧化碳反应生成了次氯酸 C. 有色布条被空气中的氧气氧化 D. 漂白粉溶液失去了部分水分,浓度增大 |
|
| 14. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. NaHCO3 的电离方程式是 NaHCO3═Na++H++CO32﹣ B. 向硫酸中通入少量氨气,硫酸溶液的导电能力会明显增强 C. 胶体和其它分散系的本质区别是分散质粒子大小为1﹣100nm D. SO3溶于水后所得到的H2SO4溶液能导电,故SO3是电解质 |
|
| 15. 选择题 | 详细信息 |
|
同温同压下,在两个容积相同的容器中,一个盛有C2H4气体,另一个盛有N2和CO的混合气体。两容器内的气体一定具有相同的( ) ①分子数②密度③质量④质子数⑤原子数⑥电子数 A. ①④⑥ B. ①②⑤ C. ③④⑥ D. ①②③ |
|
| 16. 选择题 | 详细信息 |
|
下列物质均为a g,将它们在氧气中完全氧化的产物全部通入到足量的过氧化钠固体中,过氧化钠固体增重为a g,符合条件的物质种类有( ) ①CO ②H2 ③CH4 ④HCHO ⑤CH3COOH ⑥HCOOH A. 4 种 B. 5 种 C. 6种 D. 2种 |
|
| 17. 选择题 | 详细信息 |
|
已知反应: ①Cl2+2KBr=2KCl+Br2, ②KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O, ③2KBrO3+Cl2=Br2+2KClO3, 下列说法正确的是( ) A. 上述3个反应都是置换反应 B. ③中1 mol氧化剂参加反应得到电子的物质的量为10 NA C. 反应②中若得到13.44L Cl2,则电子转移个数为6.02×1023 D. 氧化性由强到弱的顺序为:KBrO3>KClO3>Cl2>Br2 |
|
| 18. 选择题 | 详细信息 |
|
由Na、Mg、Al、Fe 四种金属组成的混合物,与足量的稀硫酸反应,生成H2在标准状况下的体积为6.72L,则混合物的物质的量不可能为( ) A. 0.6mol B. 0.5mol C. 0.4mol D. 0.3mol |
|
| 19. 选择题 | 详细信息 |
|
某铁的“氧化物”样品,用5mol/L盐酸0.14L恰好完全反应,所得溶液还能吸收标准状况下2.24L氯气,使其中Fe2+全部转化为Fe3+.该样品可能的化学式是( ) A. Fe5O6 B. Fe3O4 C. Fe6O7 D. Fe5O7 |
|
| 20. 选择题 | 详细信息 |
|
下列离子方程式正确的是( ) A. 向明矾溶液中逐滴滴入Ba(OH)2溶液,至沉淀质量最大时反应为:2Al3++3SO42﹣+3Ba2++6OH﹣═3BaSO4↓+2Al(OH)3↓ B. 向澄清石灰水中滴入少量NaHCO3溶液:Ca2++2OH﹣+2HCO3﹣═CaCO3↓+CO32﹣+2H2O C. 已知:2Br﹣+Cl2=2Cl﹣+Br2,Br2+2Fe2+=2Fe3++2Br﹣,向含0.2molFeBr2的溶液中通入标准状况下3.36LCl2时,发生的反应为:4Fe2++2Br﹣+3Cl2═4Fe3++Br2+6Cl﹣ D. 向NaHSO4中滴入Ba(OH)2溶液至恰好显中性:H++SO42﹣+Ba2++OH﹣═H2O+BaSO4↓ |
|
| 21. 填空题 | 详细信息 |
|
根据要求写出下列反应的方程式: (1)Al粉和NaOH溶液反应的化学方程式: _________________________________。 (2)漂白粉露置于空气中较长时间后失效的化学方程式: _________________________。 (3)铁粉和水蒸气反应化学方程式:_______________________________________。 (4)Cl2通入NaOH溶液中,发生反应的离子方程式:________________________。 (5)NaAlO2溶液中通入少量CO2,发生反应的离子方程式:___________________。 |
|
| 22. 推断题 | 详细信息 |
框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。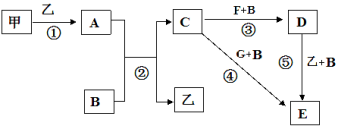 请问答下列问题: (1)反应①-⑤中,既属于氧化还原反应又属于化合反应的是______________(填序号)。 (2)反应⑤的化学方程式为____________________________。 (3)甲与B反应的离子方程式 ______________________________。 (4)在实验室将C溶液滴入F溶液中,观察到的现象是_____________。 (5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:___________。 |
|
| 23. 填空题 | 详细信息 |
2017年3月21日是第二十五届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3—、CO32—、SO42—中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关图像如下所示: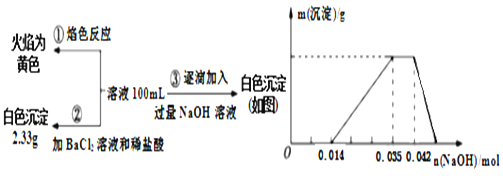 请回答下列问题: (1)根据上述3组实验可以分析废水中一定不存在的阴离子是_________________,一定存在的阳离子是__________________________。 (2)写出实验③图像中沉淀开始减少至完全消失阶段发生反应的离子反应方程式:__________________。 (3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为______________________,所得沉淀的最大质量是_____________________g。 (4)若通过实验确定原废水中c(Na+)=0.14 mol·L¯1,试判断原废水中NO3¯是否存在?_______(填“存在”“不存在”或“不确定”)。 若存在,c(NO3¯)=___________mol·L¯1。(若不存在或不确定则此空不填) |
|
| 24. 实验题 | 详细信息 |
|
硅是信息技术的关键材料,在工业中可利用镁制取硅:2Mg(过量)+SiO2 I.如图是实验室进行Mg与SiO2反应的裝置:  (1)盛放稀硫酸的装置为_________________,由于氧气的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用_________(填序号)。 a.石灰石 b.锌粒 c.纯碱 (2)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸。可观察到闪亮的火星,产生此现象的原因用化学方程式表示为 ①____________________; ②_________________。 II.利用如图装置(量气管“0”刻度在刻度线的最上方)可测定生成物的纯度。 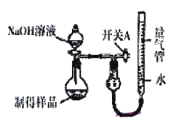 (3)实验开始前应先_________________。 (4)若取样品Wg加入5mLNaOH(足量)充分反应。反应前量气管液面读数为V1mL,反应后为V2mL(实验数据均转化为标准状况下),则样品的纯度为____________________。(写出计算式,不化简)。 (5)若反应结束时读数前未调节量气装置两边液面高度相平(右边的液面高于左边液面),则会导致实验结果______(填“偏高”、“偏低”或“无影响”)。 |
|
| 25. 填空题 | 详细信息 |
5.00g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。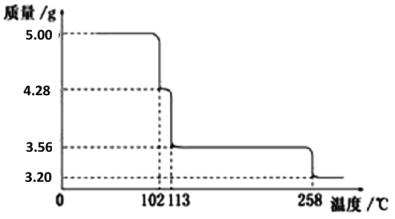 请回答下列问题: (1)试确定110℃时固体物质的化学式_____________________; (2)取200℃所得样品,加热至280oC, 该反应的化学方程式为:_______________; (3)将280oC所得产物在570℃下灼烧得到的主要产物是1.60g黑色粉末和一种氧化性气体,黑色粉末的化学式为______________。 (4)把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体其存在的最高温度是______; (5)天平两端各放一只质量相等的烧杯,内盛等体积等浓度的足量稀盐酸,将物质的量都为amol的铝和镁分别放入左盘和右盘的烧杯中,反应完毕后,在哪一盘的烧杯中加入多少克同种金属才能平衡 ________。 |
|
最近更新



