荔波高级中学高三化学上册期末考试题免费试卷
| 1. 选择题 | 详细信息 |
|
下列关于仪器的使用方法正确的是( ) A.烧瓶、锥形瓶、量筒加热时均需要垫石棉网 B.加热试管时先均匀加热,后局部加热 C.用10 mL的量筒准确量取8.80 mL的稀硫酸 D.坩埚加热时直接放在铁圈或三脚架上加热 |
|
| 2. 选择题 | 详细信息 |
|
室温下,下列各组离子在指定溶液中能大量共存的是 A. B. C. D. |
|
| 3. 选择题 | 详细信息 |
|
将Na2O2投入FeCl3溶液中,可观察到的现象是 ( ) ①生成白色沉淀 ②生成红褐色沉淀 ③有气泡产生 ④因为Na2O2具有漂白性,所以FeCl3溶液褪色 A. ①④ B. ②③ C. ①③ D. 仅② |
|
| 4. 选择题 | 详细信息 |
研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是 A. 雾和霾的分散剂相同 B. 雾霾中含有硝酸铵和硫酸铵 C. NH3是形成无机颗粒物的催化剂 D. 雾霾的形成与过度施用氮肥有关 |
|
| 5. 选择题 | 详细信息 |
|
主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是 A. 常温常压下X的单质为气态 B. Z的氢化物为离子化合物 C. Y和Z形成的化合物的水溶液呈碱性 D. W与Y具有相同的最高化合价 |
|
| 6. 选择题 | 详细信息 |
我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na A. 放电时,ClO4-向负极移动 B. 充电时释放CO2,放电时吸收CO2 C. 放电时,正极反应为:3CO2+4e− =2CO32-+C D. 充电时,正极反应为:Na++e−=Na |
|
| 7. 选择题 | 详细信息 |
|
分析下列反应,在任何温度下均能自发进行的是 A. 2N2(g)+O2(g)=2N2O(g)ΔH=+163 kJ·mol-1 B. Ag(s)+ C. HgO(s)=Hg(l)+ D. H2O2(l)= |
|
| 8. 综合题 | 详细信息 |
|
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。 方法1:还原沉淀法 该法的工艺流程为:CrO42- 其中第①步存在平衡:2CrO42-(黄色)+2H+ (1)若平衡体系的pH=2,该溶液显色_________。 (2)能说明第①步反应达平衡状态的是___________。 A.Cr2O72-和CrO42-的浓度相同 B.2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变 (3)第②步中,还原1mol Cr2O72-离子,需要_________mol的FeSO4∙7H2O。 (4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) 方法2:电解法 该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。 (5)用Fe做电极的原因为____________。 (6)在阴极附近溶液pH升高的原因是__________(用电极反应解释),溶液中同时生成的沉淀还有_____________。 |
|
| 9. | 详细信息 |
晶体硅是信息科学和能源科学中的一种重要材料,可用于制芯片和太阳能电池等。以下是工业上制取纯硅的一种方法。 请回答下列问题(各元素用相应的元素符号表示): (1)在上述生产过程中,属于置换反应的有____(填反应代号)。 (2)写出反应③的化学方程式_______。 (3)化合物W的用途很广,通常可用作建筑工业和造纸工业的黏合剂,可作肥皂的填充剂,是天然水的软化剂。将石英砂和纯碱按一定比例混合加热至1 373~1 623 K反应,生成化合物W,其化学方程式是___。 (4)A、B、C三种气体在“节能减排”中作为减排目标的一种气体是___(填化学式);分别通入W溶液中能得到白色沉淀的气体是______(填化学式)。 (5)工业上合成氨的原料H2的制法是先把焦炭与水蒸气反应生成水煤气,再提纯水煤气得到纯净的H2,提纯水煤气得到纯净的H2的化学方程式为_______。 |
|
| 10. 推断题 | 详细信息 |
|
A、B、C、D、E、F、G、H是相对分子质量依次增大的气体,它们均由短周期元素组成,具有如下性质: ①B能使湿润的红色石蕊试纸变蓝,A、C、D不能使湿润的石蕊试纸变色,E、G均可使湿润的蓝色石蕊试纸变红; ②F呈红棕色; ③G和H均能使品红褪色,A在H中安静燃烧并产生苍白色火焰; ④C在D中完全燃烧生成E和H2O,同时放出大量热,工业上可利用该反应焊接或切割金属。 请回答下列问题: (1)E的电子式为_____,D中所含元素的基态原子核外电子排布式为___,C分子中的σ键和π键的个数之比为___。 (2)写出实验室用固体药品制取B的化学方程式_______________。 (3)若从a口通入气体G,从b口通入气体F,X为氯化钡溶液,观察到的现象是_____________, 反应的离子方程式为_________________。 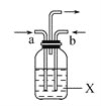 (4)已知:E(g)+3A(g) 2CH3OH(l) 写出E有催化剂时与A合成二甲醚(CH3OCH3)的热化学方程式_____________。 (5)气体C能使硫酸酸化的高锰酸钾溶液褪色,产物之一是E,该反应的化学方程式为___________。 |
|
高中化学 试卷推荐
- 2017-2018年高一上学期期中考试化学考试(西藏林芝市第二中学)
- 2018年高考化学二轮专题复习 综合复习:有机化学(备考)
- 2017-2018年高三前半期化学期中考试考试题(吉林省白山市抚松五中、长白山实验中学、长白山二中、长白山实验中学联考)
- 2019届高三9月月考化学题开卷有益(山西省朔州市应县第一中学)
- 北京高二化学期末考试(2018年下期)试卷带答案和解析
- 高中化学人教版 必修2 第一章 物质结构 元素周期律 第二节 元素周期律 元素周期表和元素周期律的应用
- 2016-2017年高一上册化学期中考试考试题(山东省德州市陵城一中)
- 2017-2018年高二上册第二次阶段性考试化学试卷(安徽省六安市第一中学)
最近更新



