高中化学人教版 必修2 第一章 物质结构 元素周期律 第二节 元素周期律 元素周期表和元素周期律的应用
| 1. | 详细信息 |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是(? )。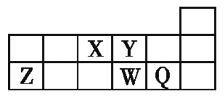 A.Y原子的电子总数是其K层电子数的3倍 B.原子半径大小顺序为r(X)>r(Y)>r(Z)>r(W)>r(Q) C.Q的单质能与W的氢化物发生置换反应 D.元素W的最高价氧化物对应水化物的酸性比Q的强 |
|
| 2. | 详细信息 |
|
对于元素周期表,下列叙述中不正确的是(? )。 A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 C.在金属元素区域可以寻找制备新型农药材料的元素 D.周期表中位置靠近的元素性质相近 |
|
| 3. | 详细信息 |
|
元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是(? )。 A.元素原子的最外层电子数等于元素的最高化合价数 B.多电子原子中,在离核较近的区域内运动的电子能量较高 C.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
|
| 4. | 详细信息 |
|
下列叙述正确的是(? ) A.道尔顿发现了元素周期律,制订了第一张科学的元素周期表 B.短周期中包含了18种原子 C.元素的性质呈现周期性变化的根本原因是核外电子排布的周期性变化 D.周期表中所有元素,都是从自然界中发现的 |
|
| 5. | 详细信息 |
|
无机化学命名委员会在1989年作出决定,把长式元素周期表原先的主、副族及族号取消,由左到右改为18列。按此规定,下列说法中错误的是(? ) A.第15列元素的最高价氧化物的化学式是R2O3 B.第17列元素单质熔、沸点逐渐升高 C.第11列中肯定没有非金属元素 D.在18列元素中,第3列的元素种类最多 |
|
| 6. | 详细信息 |
|
下列有关原子结构和元素周期律表述正确的是(? ) ①原子序数为15的元素的最高化合价为+3 ②ⅦA族元素是同周期中非金属性最强的元素 ③第二周期ⅣA族元素的原子核电荷数和中子数一定为6 ④原子序数为12的元素位于元素周期表的第三周期ⅡA族 A.①② B.①③ C.②④ D.③④ |
|
| 7. | 详细信息 |
|
依据元素周期表及元素周期律,下列推断中正确的是(? ) A.同一周期元素的原子半径越小越容易失去电子 B.ⅠA族元素的金属性比ⅡA族元素的金属性强 C.向氢硫酸溶液中滴入氯水有单质硫生成,可以验证硫元素的非金属性比氯元素弱 D.主族元素的最高正化合价等于该元素原子的核外电子数 |
|
| 8. | 详细信息 |
|
下列比较错误的是(? ) A.原子半径:N>O>F B.酸性强弱:HNO3>H3PO4>H2SO4 C.碱性强弱:KOH>NaOH>Mg(OH)2 D.氢化物的稳定性:HF>HCl>H2S |
|
| 9. | 详细信息 |
如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等。下列叙述中不正确的是(? ) A.三种元素的原子半径的大小顺序是W<Y<X B.W最高价氧化物对应水化物具有强酸性,气态氢化物的水溶液具有弱碱性 C.X元素的氧化物、氢化物的水溶液都呈酸性 D.Y元素的单质是非金属单质中唯一能跟水发生激烈反应的单质 |
|
| 10. | 详细信息 | ||||
A、B、C三种短周期元素在元素周期表中的相对位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和为C的质子数,现有以下说法,其中判断正确的组合是(? )
①B与C均存在同素异形体 |
|||||
| 11. | 详细信息 |
(双选)如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是(? ) A.Y元素的非金属性是表中所列元素中最强的 B.X的最高正价可能为+6价 C.W的最高正化合价与最低负化合价的绝对值可能相等 D.Z的最高价氧化物的水化物可能为强碱 |
|
| 12. | 详细信息 |
|
铊盐与氰化钾被列为A级危险品,铊(Tl)的原子序数为81,Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag===Tl++2Ag+且已知Ag++Fe2+===Ag+Fe3+,则下列推断正确的是(? ) A.Tl+最外层有3个电子 B.氧化性:Tl3+>Ag+>Fe3+ C.Tl(OH)3与Al(OH)3相似,也是两性氢氧化物 D.铊位于第五周期ⅢA族 |
|
| 13. | 详细信息 |
|
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是(? ) A.元素Y、Z、W形成的离子具有相同电子层结构,其离子半径依次增大 B.39 g Z2Y2中含有的离子数约为1.204×1024 C.元素Z、R的氧化物的水化物之间相互反应生成的盐一定是正盐 D.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR |
|
| 14. | 详细信息 |
|
(1)X元素的原子核外有2个电子层,其中L层有5个电子,该元素在周期表中的位置是? ? ,最高价氧化物的化学式为? ? ,该元素的氢化物和最高价氧化物对应的水化物反应的化学方程式为 。 (2)Y为短周期元素,若其最高价氧化物对应水化物的化学式为HYO3,则此时Y元素的化合价为 ,Y原子的最外层电子数为 ,其气态氢化物的化学式为? 。 |
|
| 15. | 详细信息 |
|
原子结构示意图为 |
|
| 16. | 详细信息 |
|
根据元素周期表1~20号元素的性质和递变规律,回答下列问题: (1)属于金属元素的有 种,其中金属性最强的元素的单质与氧气反应生成的化合物的化学式为 (填两种)。 (2)最高正化合价最高的元素是? ? (填元素符号),其最高正化合价为? ? 。 (3)单质既能与HCl反应,又能与NaOH反应的是? ? ,其最高价氧化物对应的水化物具有 (填“酸性”“碱性”或“两性”)。 (4)第三周期中,原子半径最大的元素是(稀有气体元素除外)? ? 。 (5)比较Si、N最简单氢化物的稳定性: (用化学式表示)。 |
|
| 17. | 详细信息 |
|
A、B、C、D、E五种元素的原子序数依次递增,且均属于短周期元素,已知A是非金属元素,其电子层数与最外层电子数相等。Bn+和C(n+1)+与氖原子具有相同的电子层结构,且C是两性元素。Dn-、E(n-1)-与氩原子具有相同的电子层结构。 (1)写出这五种元素的元素符号 A.__________;B.__________;C.__________;D.__________;E.__________。 (2)写出E单质与NaOH溶液反应的化学方程式:____________________。 (3)比较A、B、C、D、E的半径大小_____________________。 |
|
最近更新



