2017-2018年高一上学期期中考试化学考试(西藏林芝市第二中学)
| 1. | 详细信息 | |||||||||||||||
对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴上危险警告标签。下面图所列物质,贴错了包装标签的是( )
|
||||||||||||||||
| 2. | 详细信息 |
|
下列实验操作正确的是( ) ①称量时,将氢氧化钠固体放在滤纸上称量 ②可用氯化铁溶液除去试管内难以刷去的铜迹 ③分液时,分液漏斗中下层液体从下口放出,上层液体也从下口放出 ④石油的蒸馏实验中,应注意加热之前先接通冷却水,而停止加热后,仍要继续通冷却水一段时间 A. ①④ B. ③④ C. ②④ D. ①③ |
|
| 3. | 详细信息 |
|
下列仪器名称为“分液漏斗”的是( ) A. |
|
| 4. | 详细信息 |
|
下列各组混合物中,能用分液漏斗进行分离的是 A. 碘和四氯化碳 B. 水和四氯化碳 C. 酒精和水 D. 酒精和汽油 |
|
| 5. | 详细信息 |
|
下列关于萃取的操作说法正确的是( ) A. 从溴水中提取溴,可加入酒精作萃取剂 B. 萃取时,所加入的溶剂应与原溶剂互不相溶,且与溶质相互间不反应 C. 用一种有机溶剂,提取水溶液中的某物质,静置分液后,“水层”应在上层 D. 萃取操作完成后,静置分液,上、下层液体均从下口放出 |
|
| 6. | 详细信息 |
|
“粗盐提纯”实验中,下列操作正确的是 A. 过滤时用玻璃棒搅拌漏斗内的液体,以加速过滤 B. 蒸发到析出晶体时才需要用玻璃棒搅拌 C. 当蒸发皿中出现较多晶体时就应停止加热 D. 待溶液蒸干后即可停止加热 |
|
| 7. | 详细信息 |
|
容量瓶是配制一定物质的量浓度溶液的定量仪器,在容量瓶上标有的是( ) ①温度 ②浓度 ③容量 ④压强 ⑤刻度线 A. ①③⑤ B. ③⑤ C. ①⑤ D. ②③⑤ |
|
| 8. | 详细信息 |
|
下列化学实验基本操作错误的是( ) A. 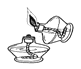 点燃酒精灯 B. 点燃酒精灯 B.  检查气密性 C. 检查气密性 C.  闻气体气味 D. 闻气体气味 D. 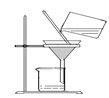 过滤粗盐水 过滤粗盐水 |
|
| 9. | 详细信息 |
|
下列实验基本操作(或实验注意事项)中,主要是处于实验安全考虑的是( ) A. 实验剩余的药品不能放回原试剂瓶 B. 可燃性气体点燃前先验纯 C. 分液漏斗在使用前先检漏 D. 滴管不能交叉使用 |
|
| 10. | 详细信息 |
|
下列物质中摩尔质量最大的是( ) A. 8g CH4 B. 9mLH2O C. 5.6LO2(STP) D. 0.8molH2SO4 |
|
| 11. | 详细信息 |
|
下列关于摩尔的叙述正确的是( ) A. 表示物质质量的单位 B. 表示物质数量的单位 C. 表示物质的量的单位 D. 既是物质的量的单位又是物质质量的单位 |
|
| 12. | 详细信息 |
|
某学生血液化验单中“萄萄糖”的结果为5.04×10-3mol/L。这里“5.04×10-3mol/L”表示葡萄糖的( ) A. 物质的量 B. 摩尔质量 C. 质量分数 D. 物质的量浓度 |
|
| 13. | 详细信息 |
|
m g O2中含n个氧原子,则阿伏加德罗常数的值可表示为 A. 2n B. 16n/m C. 32n/m D. n |
|
| 14. | 详细信息 |
|
1mol H2O中含有的H2O分子数约为( ) A. 3.01×1023 B. 6.02×1023 C. 3 D. 1 |
|
| 15. | 详细信息 |
|
化学非常重视分类。从化学物质分类角度看,和其他三种物质不属于一类的是 A.Na2SO4 B.NaOH C.Na2CO3 D.NaHCO3 |
|
| 16. | 详细信息 |
|
下列叙述正确的是( ) A. 1 mol H2O的质量为18g/mol B. CH4的摩尔质量为16g C. 0.5 molSO2分子的质量为32g D. 标准状况下,1 mol任何物质体积均为22.4L |
|
| 17. | 详细信息 |
|
下列有关物质的量和摩尔质量的叙述,正确的是( ) A.水的摩尔质量是18 g B.0.012 Kg 12C中约含有6.02×1023个碳原子 C.1 mol水中含有2 mol氢和1 mol氧 D.1 mol任何物质都含有6.02×1023个分子 |
|
| 18. | 详细信息 |
|
下列实验方案设计中,可行的是( ) A. 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 B. 用萃取的方法分离汽油和煤油 C. 用溶解、过滤的方法分离KNO3和NaCl固体的混合物 D. 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
|
| 19. | 详细信息 |
|
胶体的最本质的特征是( ) A. 丁达尔效应 B. 可以通过滤纸 C. 布朗运动 D. 分散质颗粒的大小在1nm~100nm之间 |
|
| 20. | 详细信息 |
如图为实验室制取自来水的装置示意图,根据图示回答下列问题。 (1)图中的两处明显的错误是____________________、_____________________。 (2)A仪器的名称是______________,B仪器的名称是_______________。 (3)实验时A中除加入少量自来水外,还需加入少量___________,其作用是_________。 |
|
| 21. | 详细信息 |
如图为配制240mL0.2mol?L-1Na2CO3溶液的示意图。回答下列问题: (1)①中称得Na2CO3__________g。 (2)玻璃棒在②、③两步中的作用分别是____________、_____________。 (3)若出现如下情况,对所配溶液浓度有何影响?(填 “偏高”“偏低”或“无影响”) A.某同学在第⑧步观察液面时时俯视___________; B.没有进行操作步骤④和⑤ ___________; C.在第⑤步不慎有少量液体流到容量瓶外_____________。 |
|
| 22. | 详细信息 |
| 32 g O2的物质的量是多少?含有多少个氧气分子?在标准状况下的体积是多少? | |
| 23. | 详细信息 |
|
2.8g铁与100 mL稀硫酸恰好完全反应,反应前后溶液体积的变化忽略不计。求: (1)产生的气体在标准状况下的体积。 (2)反应完全后,所得溶液中亚铁离子的物质的量浓度。 (3)稀硫酸的物质的量浓度。 |
|
最近更新







