2018-2019年高二后半期期末统考化学在线考试题带答案和解析(贵州省遵义市)
| 1. 选择题 | 详细信息 |
|
化学与人类生产、生活、可持续发展密切相关,下列说法不正确的是 A.用菜籽油浸泡花椒制得花椒油的过程是物理变化 B.饮料瓶包装上标有PET字样,则饮料瓶可回收利用 C.我省煤储存量大,为了解决我省电力紧张问题,大力发展火力发电 D.苏轼《石炭行》中“投泥泼水愈光明”包含的化学知识:高温下把水滴到炭火上,得到两种可燃性气体 |
|
| 2. 选择题 | 详细信息 |
|
下列有关化学反应原理的说法中正确的是( ) A.需要加热的反应都是非自发反应,不需要加热的反应都是自发反应 B.反应2CO(g)=C(s)+O2(g) ∆H>0,则不能自发进行 C.Ksp小的强电解质,其溶解度一定也小 D.若反应可以自发,则该反应的速率一定较快 |
|
| 3. 选择题 | 详细信息 |
|
关于热化学方程式2C4H10(g)+13O2(g)=8CO2(g)+l0H2O(l) ΔH=-5800kJ/mol的叙述不正确的是 A.丁烷在25°C,101kPa时的燃烧热为5800kJ/mol B.如果将各物质的系数改为原来的一半,ΔH=-2900kJ/mol C.该反应的反应物的总能量比生成物的总能量高 D.若该反应作为效率为65%的燃料电池,ΔH也不会发生改变 |
|
| 4. 选择题 | 详细信息 |
|
已知室温时,0.1mol•L-1某一元碱BOH在水中有0.1%发生电离,下列叙述不正确的是 A.该溶液的pH=l0 B.此碱的电离平衡常数约为1.0×10-7 C.由BOH电离出的c(OH-)为水电离出的c(OH-)的106倍 D.在该温度下加水稀释,溶液中的  减小 减小 |
|
| 5. 选择题 | 详细信息 |
|
NA是阿伏加德罗常数的值,下列说法正确的是 A.室温下,1LpH=l的盐酸中,由水电离的OH-数为0.1NA B.0.1mol/L的CH3COONa溶液中所含碳原子总数为0.2NA C.标准状况下,2.24L甲烷和乙烯的混合气体中氢原子数为0.4NA D.1.0molNaF(s)溶于水,溶液中所含F-的数目为1.0NA |
|
| 6. 选择题 | 详细信息 |
|
有机物苯乙烯( A.3种 B.4种 C.5种 D.6种 |
|
| 7. 选择题 | 详细信息 |
|
25℃时,水中存在电离平衡:H2O⇌H++OH- Kw=l×10-14。下列叙述不正确的是 A.向水中通入NH3,水的电离程度减小 B.向水中加入少量AlCl3固体,促进水的电离 C.将水加热至l00℃时,c(H+)=l×10-6,溶液显酸性 D.25℃时,某溶液中水电离出的c(OH-)=l×l0-13,则溶液可能显酸性也可能显碱性 |
|
| 8. 选择题 | 详细信息 |
|
下列有关沉淀溶解平衡的说法中,正确的一项是 A.沉淀完全就是用沉淀剂将溶液中某一离子完全除去 B.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止 C.向饱和ZnS溶液中加入少量ZnCl2固体,ZnS的Ksp不变 D.相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的相同 |
|
| 9. 选择题 | 详细信息 |
下图是工业电解饱和食盐水的装置示意图,下列有关说法不正确的是 A.该离子交换膜是阳离子交换膜 B.①处气体是H2,②处气体是Cl2 C.制得的浓NaOH溶液由B出口导出 D.水中的少量NaOH是为了增强导电性 |
|
| 10. 选择题 | 详细信息 | ||||||||
下表是在25℃时Fe2+、Fe3+、Co2+的氢氧化物完全沉淀时溶液的pH。
|
|||||||||
| 11. 选择题 | 详细信息 | |||||||||||||||
下列实验中能达到预期实验目的的是
|
||||||||||||||||
| 12. 选择题 | 详细信息 |
常温下,向25mL0.1mol/L的MOH溶液中,逐滴滴加0.1mol/L的醋酸溶液,其pH变化情况如图所示。则下列说法中一定不正确的是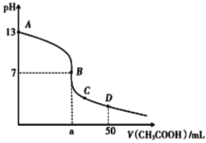 A.MOH可以溶解Al(OH)3 B.B点对应的体积a大于25mL C.C点时,有c(CH3COO-)>c(M+) D.D点时,有c(CH3COOH)>c(CH3COO-) |
|
| 13. 选择题 | 详细信息 |
从《化学反应原理》中学习到碱性锌锰电池的工作原理:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。我校课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料——MnxZn(1-x)Fe2O4,其工艺流程如下图所示: 下列说法中不正确的是 A.已知MnxZn(1-x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中的锰相同,则铁元素的化合价为+3价 B.“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,则该反应的离子方程式:MnO(OH)+Fe2++3H+=Mn2++Fe3++2H2O。 C.在“氧化”工序中,加入双氧水的目的是把Fe2+氧化为Fe3+ D.用氨水“调pH”后,从滤液C中还可分离出一种氮肥(NH4)2SO4,该氮肥的溶液中离子浓度满足关系为:c( |
|
| 14. 选择题 | 详细信息 |
随着人类社会的不断发展,大量化石燃料的燃烧所带来的能源枯竭与全球性温室效应问题日益加剧。可充电Li-CO2电池,示意图如下,该电池的工作原理是4Li+3CO2=2Li2CO3+C,在实现能量的存储与转化的同时,又能加速碳循环,为CO2的资源化利用提供了一种新的方法。 下列有关该电池的说法正确的是 A.放电时,外电路的电子流向为由b→a B.充电时,阳极质量减小,阴极质量增加 C.放电时,每转移0.4mol电子,消耗CO26.72L D.充电时,阳极的电极反应为3CO2+4Li++4e-=2Li2CO3+C |
|
| 15. | 详细信息 |
|
中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环,有效降低碳排放。 (1)已知:CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-91kJ•mol-1 2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-24kJ•mol-1 3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g) ΔH3=-247kJ•mol-1 则反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=___________。 (2)某温度下,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),测得CH3OH(g)浓度随时间变化如下图所示。  ①计算:从0min到3min,H2O的平均反应速率v(H2O)=____ mol•L-1•min-1保留两位有效数字);反应的平衡常数K=___。 ②能说明上述反应达到平衡状态的是_____填编号)。 A.混合气体的颜色不再发生变化 B.c(CO2):c(H2)=1:3 C.混合气体的平均相对分子质量保存不变 D.CO2的物质的量分数在混合气体中保持不变 (3)以甲醇为燃料的新型电池的成本大大低于以氢为燃料的传统燃料电池,下图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。  A极为电池的_______极,B电极的反应式为______。 (4)在25℃时,将ymol/L的CH3COOH与0.1mol/LNaOH溶液等体积混合,反应结束恢复至25℃,此时c(CH3COO-)=c(Na+),则此时溶液显_____性,25℃时CH3COOH的电离平衡常数为_____(用含y的代数式表示)。 |
|
| 16. 实验题 | 详细信息 |
|
硼位于IIIA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。 查阅资料:①BCl3的沸点为12.5℃,熔点为-107.3℃;②2B+6HC1 设计实验:某同学设计如图所示装置利用氯气和单质硼反应制备三氯化硼:  请回答下列问题: (1)装置A盛装浓盐酸的仪器名称为_______。 (2)A中主要反应的化学方程式为:______。 (3)E装置的作用_____,装置F的作用是______、______。 (4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:_____。 (5)装置B中若采用玻璃管,则制得的BCl3中常含有SiCl4(SiCl4)的熔点为-70℃,沸点为57.6℃)等杂质,可采用____的方法提纯BCl3。 |
|
| 17. 填空题 | 详细信息 |
|
硒(Se)是第四周期VIA族元素,是人体内不可或缺的微量元素,其氢化物H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的基础原料。 (1)T°C时,向一恒容密闭容器中加入3molH2和1molSe,发生反应H2(g)+Se(s)⇌H2Se(g)。以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图1、图2所示:  则制备H2Se的最佳温度和压强为_____。 (2)由H2Se在一定条件下制备CuSe,已知25℃时CuSe的Ksp=7.9×10-49,CuS的Ksp=l.3×10-36,则反应CuS(s)+Se2-(aq)⇌CuSe(s)+S2-(aq)的化学平衡常数K=____(保留2位有效数字)。 |
|
| 18. | 详细信息 |
烯烃A的产量标志着一个国家石油化工的水平。由烯烃A合成高分子化合物M和环状化合物N(C4H4O4)的流程图如下: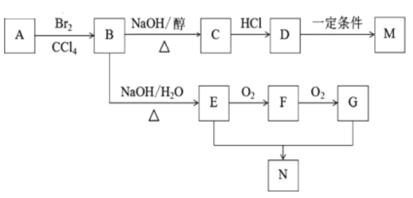 回答下列问题。 (1)烯烃A的名称是_____,若要鉴别烯烃A和丙烷两种无色气体,采用的试剂是_____。 (2)B生成E、C生成D的反应类型分别是_____、_____。 (3)D生成M的化学方程式为______。 (4)烯烃Q是烯烃A的同系物,分子中有5个碳原子,则烯烃Q同分异构体的数目为_____,其中,存在一个支链,且可以由炔烃与H2加成得到的同分异构体的结构简式为______。 (5)物质E的核磁共振氢谱共有_____组吸收峰,峰面积之比为______。 (6)E和G生成N的化学方程式为____。 |
|
| 19. | 详细信息 |
氯贝丁酯M是一种可用于降血脂的药物。实验室由卤代烃A与芳香化合物E制备M的合成路线如下: 已知:① 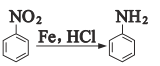 ②  (1)M中的含氧官能团名称为_____,F的结构简式为_____。 (2)G→H的反应类型为______,A→B的反应试剂与条件为______。 (3)写出I→M的化学方程式:______。 (4)P比I少2个CH2原子团,写出P的满足下列条件的同分异构体有______种。 ①该物质能使FeCl3溶液显色; ②该物质能与NaHCO3溶液反应; ③苯环上只有三个取代基 (5)参照上述合成路线,写出以F和2-丁醇为原料(无机试剂任选)制备  的合成路线流程图___。 的合成路线流程图___。 |
|
| 20. | 详细信息 | |||||||||
|
2011年,谢赫德曼因发现“准晶体”独享诺贝尔化学奖。2009年,科学家们在俄罗斯东部的河流中发现了十分耐磨的天然准晶体矿物Al63Cu24Fe13,有力地证明了准晶体理论。回答下列问题。 (1)可通过_____方法区分晶体、准晶体和非晶体。 (2)基态Fe原子的电子排布式是_____。铝和铁的第一电离能的大小次序是_____。 (3)五羰基合铁[Fe(CO)5]是一种浅黄色难溶于水的液体,其熔点-20℃,沸点103℃。依据以上信息可推断五羰基合铁属于______(“准晶体”、“离子晶体”、“分子晶体”或“原子晶体”)。 (4)二茂铁甲酰胺的结构如下图所示。其中N原子的杂化方式为______。  (5)工业用沉淀法制备磁性材料铁氧体,一般在制备的时候使用NH3和N2H4等弱碱。比较表格中的熔沸点数据,发现N2H4的熔沸点高于NH3的熔沸点,其原因是_____。
|
||||||||||
| 21. | 详细信息 |
|
钴的化合物在磁性材料生产、电池制造、催化剂制备等方面应用十分广泛。 (1)基态Co原子的核外电子排布式为______,其中,3d能级上有_____个未成对电子。 (2)化合物四氨基钴酞菁分子的结构式如图。四氨基钴酞菁中N原子的杂化轨道类型为_____。  (3)纳米结构的氧化钴可以在室温下氧化甲醛(HCHO),甲醛各原子都达到最外层稳定结构,则甲醛分子的空间构型为______。 (4)某含钴配合物的组成为CoCl3•5NH3•H2O,该配合物中Co离子的配位数是6,1mol该配合物可以与足量的硝酸银反应生成3mol AgCl沉淀,则该配合物的配体是____。 (5)已知CoCl2的颜色变化情况如下:  则实验室中的可循环硅胶干燥剂掺杂CoCl2的意义是____。 (6)一种钴的化合物可用作石油脱硫的催化剂,其晶胞结构如下图所示,则晶体中与每个O2-相邻的O2-有_________个,该钴的化合物的化学式是_____。 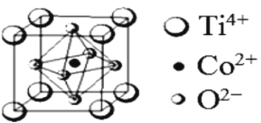 |
|
最近更新




