2019-2020年高一下半年开学考试化学试卷带参考答案和解析(广东省珠海市第二中学)
| 1. 选择题 | 详细信息 |
|
下列有关说法不正确的是( ) A.“丹砂(HgS)烧之为水银”,该反应为吸热反应 B.人类历史上大多数重金属发现和使用较早而轻金属的发现和使用则较晚 C.《吕氏春秋•别类编》中“金(即铜)柔锡柔,合两柔则刚”体现了合金硬度方面特性 D.医用酒精中乙醇的体积分数为95% |
|
| 2. 选择题 | 详细信息 |
|
实验操作的规范是实验的基本要求。下列实验操作正确的是 A.  B. B.  C. C.  D. D.  |
|
| 3. 选择题 | 详细信息 |
|
下列有关化学用语表达正确的是( ) A.35Cl-和37Cl的结构示意图均可以表示为 B.HClO的结构式:H—Cl—O C.HF的电子式: D.质子数为92、中子数为146的U原子: |
|
| 4. 选择题 | 详细信息 |
|
下列现象不能用氢键解释的是( ) A.氨易液化 B.HF比HCl分子更稳定 C.冰浮在水面上 D.HI的沸点小于HF |
|
| 5. 选择题 | 详细信息 |
|
下列关于电解质的叙述正确的是 A. 溶于水得到的溶液能导电的化合物都是电解质 B. NaCl溶液在电流作用下电离成Na+与Cl- C. 硫酸溶液的导电性一定比醋酸溶液导电性强 D. 氯化氢溶于水能导电,但液态氯化氢不能导电 |
|
| 6. 选择题 | 详细信息 |
|
镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有( ) A.AlO2- B.Cu2+ C.Al3+ D.Mg2+ |
|
| 7. 选择题 | 详细信息 |
|
下列说法中不正确的是( ) A.硝酸银溶液保存在棕色试剂瓶中 B.锂保存在煤油中 C.硅在自然界中只有化合态 D.实验室盛装NaOH溶液的试剂瓶用橡皮塞 |
|
| 8. 选择题 | 详细信息 |
|
下列变化过程,属于放热反应的是 ①金属钠与水 ②NH4Cl晶体与Ba(OH)2·8H2O混合搅拌 ③H2在Cl2中燃烧 ④液态水变成水蒸气 ⑤酸碱中和 ⑥碳酸钙热分解 A. ①②⑤ B. ①③⑤ C. ③④⑤ D. ②④⑥ |
|
| 9. 选择题 | 详细信息 |
|
下列各组中两种物质反应时,反应条件或反应物用量改变,对生成物没有影响的是( ) A.S与O2 B.Fe与HNO3 C.Na2SO3溶液与盐酸 D.NaAlO2溶液与CO2 |
|
| 10. 选择题 | 详细信息 |
|
下列有关硫及其化合物性质的说法中,正确的是 A.铜粉和硫粉混合加热可制得CuS B.久置酸雨酸性增强,原因是水的挥发 C.SO2通入石蕊试液中,溶液颜色先变红,再褪色 D.亚硫酸钠暴露在空气中容易被氧化成硫酸钠 |
|
| 11. 选择题 | 详细信息 |
|
从氧化还原角度分析,下列反应中水的作用相同的是 ①铁和水蒸气反应 ②过氧化钠和水反应 ③氯气和水反应 ④二氧化氮和水反应 A.①②③ B.①②④ C.②③④ D.①③④ |
|
| 12. 选择题 | 详细信息 |
|
下列离子方程式正确的是( ) A. 金属钠和水反应:Na + 2H2O=Na+ + 2OH―+ H2↑ B. 用氢氧化钠溶液吸收少量二氧化硫气体:SO2 +2OH―=SO32- + H2O C. 硫酸铵溶液和氢氧化钡溶液反应:Ba2+ + SO42-=BaSO4↓ D. 碳酸氢钠溶液和过量的澄清石灰水混合:2HCO3―+ Ca2+ + 2OH―=CaCO3↓+ CO32- + 2H2O |
|
| 13. 选择题 | 详细信息 |
|
下列说法错误的是( ) A.铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 B.氯气能使湿润的淀粉碘化钾试纸变蓝,说明Cl2具有氧化性 C.实验室一般通过加热NH4Cl制备氨气 D.“84”消毒液的有效成分为NaClO,它与洁厕灵(主要成分为盐酸)混合会生成氯气 |
|
| 14. 选择题 | 详细信息 |
|
下列各组离子在指定环境中一定能大量共存的是( ) A.使pH试纸显蓝色的溶液中:Cu2+、NO3-、Fe3+、SO42- B.与铝粉反应放出氢气的无色溶液中:NO3-、Al3+、Na+、SO42- C.pH=1的溶液中:Al3+、NH4+、Ca2+、ClO- D.使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+ |
|
| 15. 选择题 | 详细信息 |
|
钛和钛的合金具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,尤其是钛合金与人体器官具有很好的“生物相容性”。下列有关钛用途不合适的是( ) A.用来做保险丝 B.用于制造航天飞机 C.用来制造人造骨 D.用于家庭装修,做钛合金装饰门 |
|
| 16. 选择题 | 详细信息 |
|
下列选用的除杂方法不正确的是(括号内为杂质) A. CO2(HC1)通过足量的饱和碳酸钠溶液、干燥 B. SiO2(H2SiO3)加热,使 H2SiO3分解 C. Cl2(HC1)通过足量的饱和氯化钠溶液、干燥 D. FeCl2溶液(FeCl3)加过量的Fe粉、过滤 |
|
| 17. 选择题 | 详细信息 |
|
下列比较正确的是 A. 还原性:HF>H2O>NH3 B. 金属性:Mg>Ca>Ba C. 热稳定性:HBr>HCl>HF D. 酸性:HClO4>H2CO3>HClO |
|
| 18. 选择题 | 详细信息 |
|
海带中含有碘元素。从海带中提取的碘的步骤如下: ①海带焙烧成灰加入水搅拌②过滤③向滤液中加入稀H2SO4和H2O2④加入CCl4萃取⑤分液。下列说法中不正确的是( ) A.步骤②中用到的玻璃仪器有漏斗、烧杯、玻璃棒 B.步骤③中涉及的离子方程式为:2I-+H2O2+2H+=I2+2H2O C.步骤④中可用酒精代替CCl4 D.步骤⑤中获得I2从分液漏斗下口倒出 |
|
| 19. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的数值,下列说法正确的是( ) A.23gNa与足量H2O反应完全后可生成NA个H2分子 B.1molAl和足量NaOH溶液反应生成的H2体积一定为33.6L C.标准状况下,22.4LN2和H2混合气体中含NA个原子 D.3mol单质Pb完全转变为Pb3O4失去8NA个电子 |
|
| 20. 选择题 | 详细信息 | |||||||||||||||
下列实验过程可以达到实验目的的是( )
|
||||||||||||||||
| 21. 选择题 | 详细信息 | ||||||||||||||||||
几种短周期元素的原子半径及主要化合价见下表:
|
|||||||||||||||||||
| 22. 选择题 | 详细信息 |
|
短周期主族元素 W、X、Y、Z 的原子序数依次增大,W 在大气中有两种同素异形体且均能支持燃烧,X 单质能在 Z2 气体中燃烧,发出黄色火焰,Y 在同周期非金属元素中原子半径最大。下列叙述正确的是 A.Y 单质的熔点低于 X 单质 B.Z 的含氧酸均为弱酸 C.Y、Z 的单质都能在 W2 气体中燃烧 D. 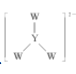 中 W 和 Y 都满足 8 电子稳定结构 中 W 和 Y 都满足 8 电子稳定结构 |
|
| 23. 综合题 | 详细信息 | ||||||||||||
(1)已知3H2(g)+N2(g)
|
|||||||||||||
| 24. 推断题 | 详细信息 |
|
原子序数由小到大排列的四种短周期主族元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2离子化合物。 (1)写出Y2O2的电子式:__,其中含有的化学键是__。 (2)将ZO2通入品红溶液再加热的现象是__。 (3)写出X的最高价氧化物对应的水化物的稀溶液与铜反应的化学方程式__。 (4)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是_(填化学式)。 (5)由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式__。 |
|
| 25. 实验题 | 详细信息 | ||||||||||||
氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题: (1)氨气的制备 ①氨气的发生装置中反应的化学方程式为__。装置C的仪器名称__。 ②欲收集一瓶干燥的氨气,选择上图中的装置,其接口连接顺序为a→__(按气流方向,用小写字母表示)。 (2)氨气与二氧化氮的反应 将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。 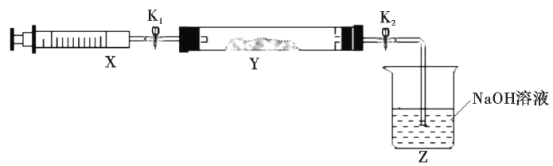
|
|||||||||||||
| 26. 填空题 | 详细信息 |
以硫铁矿(主要成分为FeS2)为原料制备硫酸亚铁晶体(FeSO4·7H2O)的工艺流程如下: 回答下列问题: (1)焙烧后得到的固体主要成分为Fe2O3。写出焙烧过程主要反应的化学方程式____________________ (2)试剂X是(写化学式)__________________ (3)设计实验检验还原得到的溶液是否达标:_________________________________________ (4)从还原得到的溶液中获得硫酸亚铁晶体(FeSO4·7H2O)的操作是_______________________ (5)可以用标准浓度的酸性KMnO4溶液来测定产品中FeSO4的纯度,反应中KMnO4被还原成Mn2+。反应的离子方程式为 __________________________________ (6)某种工业品中含有FeSO4和Fe2(SO4)3。通过元素分析得知其中铁元素和硫元素的物质的量之比n(Fe)︰n(S) =1︰1.2 ,此工业品中FeSO4的物质的量分数为___________________________ |
|
- 2017-2018年度高二上半年期末市统测模拟考化学考试(云南省峨山彝族自治县第一中学)
- 2015-2016年高三下学期理综化学开学考试题免费试卷(浙江省温州市十校联合体)
- 邢台市2019年高三化学上期月考测验完整试卷
- 2018届高三12月月考化学考试题(广西陆川县中学)
- 2017-2018年高二上半年第二次月考化学考题带答案和解析(福建省莆田九中)
- 2018届高三上学期第五次月考理科综合-化学试卷(江西省南昌市第二中学)
- 2017-2018年高一上学期第二次阶段性检测化学考题带答案和解析(湖南省长沙市第一中学)
- 2017-2018年高一上学期第二次月考化学考题带答案和解析(河南省商丘市第一高级中学)




