2018年至2019年高一上学期12月阶段性测试化学题开卷有益(宁夏回族自治区银川一中)
| 1. 选择题 | 详细信息 |
|
下列物质中的硫元素不能表现氧化性的是 A. Na2S B. S C. SO2 D. H2SO4 |
|
| 2. 选择题 | 详细信息 |
|
分别向下列各溶液中加入少量NaOH固体,溶液的导电能力变化最小的是( ) A. 水 B. 醋酸溶液 C. 盐酸 D. NaCl溶液 |
|
| 3. 选择题 | 详细信息 |
|
关于钠的描述正确的是 ①钠在自然界既有游离态又有化合态存在 ②金属钠着火可以用泡沫灭火器救火 ③钠的密度比煤油大 ④Na﹣K合金做原子反应堆的导热剂 ⑤钠比铜活泼,因而钠可以从CuCl2溶液中置换出铜 ⑥钠在空气中燃烧,主要产物是Na2O2 A. ①③④⑤⑥ B. ③④⑤ C. ③④⑥ D. 全部 |
|
| 4. 选择题 | 详细信息 |
|
下列说法不正确的是 A. Na2O2能与CO2反应生成O2,可用作呼吸面具的供氧剂 B. 氧化铝、氧化铁均为两性氧化物 C. 相同物质的量的CO2、H2O分别与足量Na2O2反应,生成气体的物质的量相同 D. Al2O3熔点高,可用于制作耐高温仪器 |
|
| 5. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数值。下列有关叙述正确的是 A. 5.6 g Fe在氧气中燃烧,完全反应时转移电子数为0.3NA B. 标准状况下,22.4 L氦气与22.4 L氯气所含原子数均为2 NA C. 32 gCu与S完全反应转移的电子数为0.5NA D. 1mol O2与足量Na反应,生成Na2O和Na2O2的混合物转移的电子数为2NA |
|
| 6. 选择题 | 详细信息 |
|
由锌、铁、铝、镁四种金属中的两种组成的混合物10 g,与足量的盐酸反应产生的氢气在标准状况下为11.2 L,则混合物中一定含有的金属是 A. 锌 B. 铁 C. 铝 D. 镁 |
|
| 7. 选择题 | 详细信息 |
|
关于Na2CO3和NaHCO3性质的说法不正确的是 A.热稳定性:NaHCO3<Na2CO3 B.与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3 C. 相同温度时,在水中的溶解性:NaHCO3<Na2CO3 D. 等物质的量的Na2CO3、NaHCO3分别与足量盐酸反应产生的CO2质量相同 |
|
| 8. 选择题 | 详细信息 |
|
下列制取CO2、通过CO2和NaAlO2溶液制取Al(OH)3、分离并加热Al(OH)3制Al2O3的装置和原理能达到实验目的的是 A. 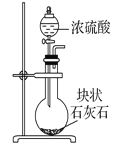 制取CO2 B. 制取CO2 B. 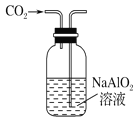 制取Al(OH)3 制取Al(OH)3C. 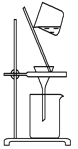 分离Al(OH)3 D. 分离Al(OH)3 D. 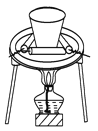 制Al2O3 制Al2O3 |
|
| 9. 选择题 | 详细信息 |
|
既能与盐酸反应又能与氢氧化钠溶液反应的化合物是 ①Al ②NaHCO3 ③Al2O3 ④Mg(OH)2 ⑤Al(OH)3 A. ①②③⑤ B. ①④⑤ C. ②③⑤ D. ①③④ |
|
| 10. 选择题 | 详细信息 |
|
下列各组试剂中,只用试管和胶头滴管,不用其他试剂就可以鉴别的是 A. NaOH(aq)和Al2(SO4)3 (aq) B. 稀盐酸和NaHCO3 (aq) C. CaCl2(aq)和Na2CO3(aq) D. Ba(OH)2(aq)和Na2SO4(aq) |
|
| 11. 选择题 | 详细信息 |
|
下列说法正确的是 A. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来说明金属铝的熔点较低 B. 用如图装置进行实验,将装置①中的AlCl3滴入装置②浓氢氧化钠,溶液中可观察到有大量白色沉淀产生  C. Na2O2在空气中久置变白,涉及的氧化还原反应中,Na2O2是还原剂H2O是氧化剂 D. 向明矾溶液里滴加Ba(OH)2溶液,当SO42-恰好完全沉淀时,铝元素几乎全部以AlO2—形式存在于溶液中 |
|
| 12. 选择题 | 详细信息 |
|
下列说法正确的是 A. 焰火的五彩缤纷是某些金属元素化学性质的展现 B. Na2O中阴、阳离子的个数比为1∶1 C. 向氯化铝溶液中加入过量氨水反应的实质是Al3++3NH3·H2O===Al(OH)3↓+3NH D. 将等物质的量的氧化钠和过氧化钠分别投入到足量且等质量的水中,得到溶质质量分数分别是a%和b%的两种溶液,则a和b的关系是a<b |
|
| 13. 选择题 | 详细信息 |
|
在加入铝粉能放出氢气的溶液中,下列各组离子可能大量共存的是 A. Na+,K+, C. Mg2+,Fe3+,I-, |
|
| 14. 选择题 | 详细信息 | |||||||||||||||
下列实验操作正确的是
|
||||||||||||||||
| 15. 选择题 | 详细信息 | |||||||||||||||||||||||||
下表各组物质之间通过一步反应不可以实现如图所示转化关系的是
|
||||||||||||||||||||||||||
| 16. 选择题 | 详细信息 |
|
现有200mL MgCl2、AlCl3的混合液,其中c(Mg2+)=0.2mol·L-1 ,c(Cl-)=1.3 mol· A. 140mL B. 120mL C. 100mL D. 80mL |
|
| 17. 选择题 | 详细信息 |
|
将1.5 mol Cu2S和足量稀HNO3反应,生成Cu(NO3)2、H2SO4、NO和H2O。则参加反应的硝酸中被还原的硝酸的物质的量是 A. 5 mol B. 1.5 mol C. 6 mol D. 1mol |
|
| 18. 填空题 | 详细信息 |
|
钠、铝、铁是三种重要的金属。请回答: (1)钠的金属活动性比铝的________(填“强”或“弱”)。 (2)将一小块金属钠投入水中,发生反应的离子方程式为__________________________; (3)Fe跟盐酸反应所得含铁元素产物的化学式是________。 (4)镁粉中若混有铝粉可用氢氧化钠溶液除去,反应的化学方程式为________。 |
|
| 19. 综合题 | 详细信息 |
有一透明溶液,可能含有Al3+、Fe3+、K+、NH4+、Mg2+和Cu2+等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。加入Na2O2的量与生成白色沉淀的量之间的关系用图来表示。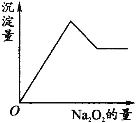 试推断: (1)原溶液中一定含有________。 (2)一定不含有________。 (3)可能含有________。 (4)为了进一步确定可能含有的离子,应增加的实验方法为________。 |
|
| 20. 实验题 | 详细信息 |
为测定已部分变质的过氧化钠(假定杂质全部为碳酸钠)的纯度,设计了如下图所示的实验.图中Q为一具有良好弹性的气球(气球不参与反应,也不会被腐蚀),称取一定量的样品放入其中,按图安装的实验装置打开分液漏斗的活塞,将稀硫酸滴入气球中.请填空: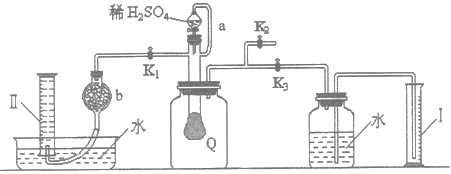 (1)Q内发生反应生成了两种气体,这两种气体的分子式为O2、CO2,写出反应的离子方程式:________。 (2)导管a的作用是________。 (3)为测定反应生成气体的总体积,滴稀硫酸前必须关闭________(填K1、K2、K3,下同),打开________。 (4)当上述反应停止后将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是________。 (5)b中装的固体试剂是________。 |
|
| 21. 推断题 | 详细信息 |
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化: 据此回答下列问题: (1)I、II、III、IV四步中分离溶液和沉淀所采取的操作名称是____________。 (2)①、③反应的离子方程式: ①_____________________________________________________________; ③_____________________________________________________________。 (3)有人认为③用盐酸不是太好,改为通入足量的一种气体,这种气体为______。该离子反应方程式为:________。 |
|
最近更新



