2019届高三下学期3月综合练习化学考试(北京市门头沟区)
| 1. | 详细信息 | ||||||||||||
根据所给的信息和标志,判断下列说法不正确的是
|
|||||||||||||
| 2. | 详细信息 |
|
下列生活应用实例中,涉及氧化还原反应的是 A. 用白醋去除水垢 B. 用热的纯碱溶液清洗油污 C. 用风油精(含石蜡油)清洗透明胶残胶 D. 补铁剂(有效成分为Fe2+)与含维生素C共服效果更佳 |
|
| 3. | 详细信息 | ||||||
氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
|
|||||||
| 4. | 详细信息 |
中国化学家研究的一种新型复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是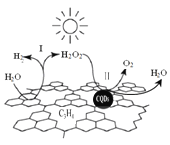 A. C3N4中C的化合价为 -4 B. 反应的两个阶段均为吸热过程 C. 阶段Ⅱ中,H2O2既是氧化剂,又是还原剂 D. 通过该反应,实现了化学能向太阳能的转化 |
|
| 5. | 详细信息 | |||||||||||||||
下列“实验结论”与“实验操作及现象”相符合的一组是
|
||||||||||||||||
| 6. | 详细信息 |
|
2012年,国际纯粹与应用化学联合会(IUPAC)宣布第116号元素命名为鉝(Livermorium),元素符号是Lv。现有短周期主族元素X、Y、Z、W,原子序数依次增大,其中X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于IA族,W与X属于同一主族。下列说法正确的是 A. 116号元素与元素X、W原子最外层电子数相同 B. 由Y、Z两种元素组成的化合物是共价化合物 C. W的简单气态氢化物的热稳定性比Y的强 D. 原子半径:r(X)<r(Y)<r(Z)<r(W) |
|
| 7. | 详细信息 | ||||||||||||||
80℃时,1L 密闭容器中充入0.20 mol N2O4,发生反应N2O4
|
|||||||||||||||
| 8. | 详细信息 |
|
按下列路线合成新抗凝(抗血栓药物) 新抗凝  已知:I: 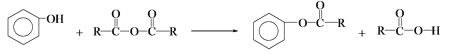 II: 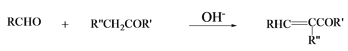 III: (1)  所需的试剂是__________。 所需的试剂是__________。(2) B→C分两步进行,反应类型分别是 __________、__________。 (3)下列说法不正确的是_________。 a.化合物B能使Br2/CCl4褪色 b. 化合物C能发生银镜反应 c.F遇FeCl3溶液显色 d. 新抗凝的分子式C19H15NO6 (4)E+H→新抗凝的化学方程式是_______________________。 (5)已知:  (6)写出一种符合下列条件的A的同分异构体的结构简式_____________________。 ① 红外光谱表明分子中含有-COO-、苯环结构 ② 1H-NMR谱显示苯环上有三种不同环境的H原子 |
|
| 9. | 详细信息 |
|
CO2的排放会带来全球“温室”效应,因此,引起国际关注和研究,渴望21世纪 CO2将作为新碳源被广泛使用。 (1)以 CO2 和 H2 为原料可得到 CH4 燃料。 已知:① CH4 (g) + CO2(g) = 2CO(g) + 2H2(g) △ H1= + 247kJ·mol-1 ② CH4 (g) + H2O(g) = CO(g) + 3H2(g) △ H2= + 205kJ·mol-1 写出由 CO2 获得CH4的热化学方程式:_____。 (2)CO2与CH4经催化重整可制得合成气:CH4(g)+CO2(g) = CO(g)+2H2(g) 按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率影响如图所示。此反应优选温度为900℃的原因是______________________。 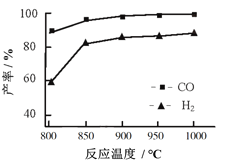 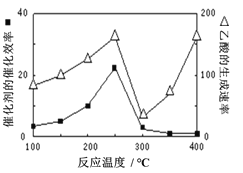 (3)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。 ① 催化剂的催化效率与乙酸的生成速率随温度的变化关系如上图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是__________________。 ② 为了提高该反应中CH4的转化率,可以采取的措施是________(写出两种) 。 ③ 将Cu2Al2O4溶解在稀硝酸中离子方程式是________________________。 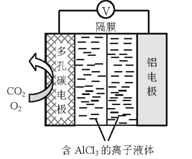 (4)O2辅助的Al—CO2电池工作原理如上图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。电池的负极反应式:_______________________。电池的正极反应式:2CO2+2e−= C2O42−该过程中,O2起催化作用,催化过程可表示为:i: 6 O2 + 6e− = 6 O2− ii: ……写出ii的离子方程式:______________________。 |
|
| 10. | 详细信息 | ||||||||||||
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下: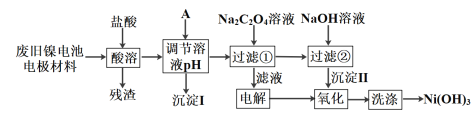 已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+ ②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O ③已知生成氢氧化物沉淀的pH如下表所示。
|
|||||||||||||
| 11. | 详细信息 | |||||||||||||||||
|
某化学兴趣小组对硫酸亚铁的一些性质进行探究。 回答下列问题: (1)配制0.5 mol·L-1 FeSO4溶液时,将称量好的硫酸亚铁溶解于一定浓度的稀硫酸溶液中,结合化学用语解释稀硫酸的作用_____________________________。 该实验小组做如下实验。
|
||||||||||||||||||