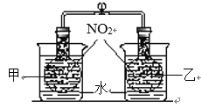
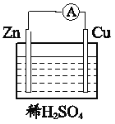
湖北省“荆、荆、襄、宜“四地七校联盟2020-2021年高二前半期期中考试化学题免费试卷在线检测
| 1. 选择题 | 详细信息 |
|
在西汉刘安组织编撰的《淮南万毕术》中,有“曾青得铁则化为铜”的记载。这说明早在西汉时期,我国劳动人民就已经发现铁能从某些含铜(+2价)化合物的溶液中置换出铜,这个反应是现代湿法冶金的基础。下列关于该反应的说法中,正确的是( ) A.该反应说明历史上铁的应用比铜早 B.该反应的离子方程式为:Fe+Cu2+=Cu+Fe2+ C.该反应说明金属单质与盐溶液的反应均为置换反应 D.该反应说明金属单质都能与盐发生反应 |
|
| 2. 选择题 | 详细信息 |
|
下列能量转化过程与氧化还原反应无关的是( ) A.硅太阳能电池工作时,光能转化成电能 B.锂离子电池放电时,化学能转化成电能 C.食物因氧化而腐败时,化学能转化热能 D.葡萄糖为人类生命活动提供能量时,化学能转化成热能 |
|
| 3. 选择题 | 详细信息 |
下列实验装置正确且能达到实验目的的是( ) A.用甲装置除去食盐水中混有的不溶杂质 B.用乙装置提纯Al(OH)3胶体 C.用丙装置制备无水酒精 D.用装置丁制取乙酸乙酯 |
|
| 4. 选择题 | 详细信息 |
|
短周期主族元素W、X、Y、Z的原子序数依次增大。工业上以金红石(主要成分是TiO2)为原料制备金属钛的步骤:①在高温下,向金红石与W的单质组成的混合物中通入黄绿色气体单质Z,得到化合物甲和化学式为WX的气体乙,气体乙会与血红蛋白结合导致人体中毒;②金属Y形成的淡黄色氧化物可用于呼吸面具。在稀有气体环境和加热条件下,用Y的金属单质与甲反应可得钛。下列说法不正确的是( ) A.W的氢化物的沸点一定小于X的氢化物 B.简单离子半径:Z>X>Y C.W与Z形成的化合物可用做工业上的重要有机溶剂 D.含Z元素的某种盐具有强氧化性,可用于饮用水消毒 |
|
| 5. 选择题 | 详细信息 |
食用自制“酸汤子”(用玉米水磨发酵后做的一种粗面条样的主食)会因椰毒假单胞菌污染产生米酵菌酸引发食物中毒。米酵菌酸的结构如图,下列说法错误的是( )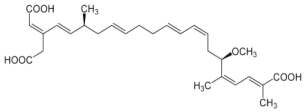 A.能与Br2发生加成反应 B.含有3种官能团 C.能与碳酸氢钠溶液反应 D.不能使稀酸性高锰酸钾溶液褪色 |
|
| 6. 选择题 | 详细信息 |
|
在已经处于化学平衡的体系中,如果下列量发生变化,化学平衡一定发生了移动的是 A.反应混合物的浓度 B.反应体系的压强 C.正、逆反应的速率 D.反应体系的温度 |
|
| 7. 选择题 | 详细信息 |
|
2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g) A.0.40mol B.0.20mol C.小于0.20mol D.大于0.20mol,小于0.40mol |
|
| 8. 选择题 | 详细信息 |
|
在密闭容器中,一定量的混合气体发生反应: A.x+y<z B.平衡向正反应方向移动 C.B的转化率降低 D.C的体积分数增大 |
|
| 9. 选择题 | 详细信息 | ||
可逆反应2NO2 (g) ⇌N2O4 (g) ΔH= −56.9 kJ·mol−1在平衡移动时的颜色变化可以用来指示放热过程和吸热过程。某同学的部分实验报告如下。
|
|||
| 10. 选择题 | 详细信息 |
|
下列措施或事实不能用勒夏特列原理解释的是( ) A.使用催化剂可加快氨的合成速率 B.H2、I2、HI平衡混合气加压后颜色变深 C.新制的氯水在光照下颜色变浅 D.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率 |
|
| 11. 选择题 | 详细信息 |
|
二甲醚(CH3OCH3)是制冷剂、局部麻醉药和燃料。工业上可利用CO2催化加氢合成二甲醚,其过程中主要发生下列反应。 反应I:CO2(g)+H2(g) 反应II:2CO2(g)+6H2(g) 一定条件下,于密闭容器中投入一定量CO2和H2发生上述反应。下列说法正确的是( ) A.其他条件不变,升高温度CO2的平衡转化率一定降低 B.其他条件不变,给体系加压反应I平衡不移动 C.其他条件不变,增大H2投入量一定能提高CH3OCH3平衡产率 D.其他条件不变,使用不同催化剂对CH3OCH3的平衡产率不产生影响 |
|
| 12. 选择题 | 详细信息 |
已知[Co(H2O)6]2+呈粉红色,[CoCl4]2-呈蓝色,[ZnCl4]2-为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: 以下结论和解释正确的是( ) A.由实验①可推知正反应的△H>0 B.实验②是由于c(H2O)增大,导致平衡逆向移动 C.由实验③可知配离子的稳定性:[ZnCl4]2->[CoCl4]2- D.原蓝色溶液中加入少量NaCl固体,实验现象与实验③相同 |
|
| 13. 选择题 | 详细信息 | ||||||||
向2L的密闭容器中充入1molA和1molB,反应A(g)+B(g)
800℃时,经5s反应达到平衡状态,此时B的平均反应速率v(B)=0.04mol/(L·s)。下列说法正确的是( ) |
|||||||||
| 14. 选择题 | 详细信息 |
下列四幅图示所表示的信息与对应的叙述相符的是( )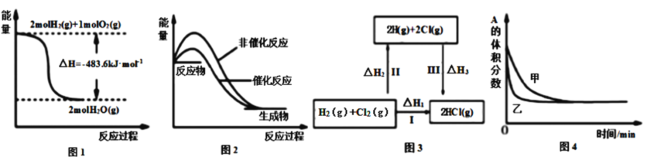 A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ·mol-1 B.图2表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 C.图3表示一定条件下H2和Cl2生成HCl的反应热与途径无关,则ΔH1=ΔH2+ΔH3 D.图4表示压强对可逆反应 |
|
| 15. | 详细信息 | ||||||
|
化学反应伴随能量变化,获取反应能量变化有多条途径。回答下列问题: (1)理论研究表明,在101kPa和298K下,  (2)已知:
计算可得: |
|||||||
| 16. | 详细信息 | ||||||||||||||||||||||||
|
纯过氧化氢(H2O2)是淡蓝色的黏稠液体,可任意比例与水混溶,广泛应用于医疗消毒、绿色化学合成等领域。回答下列问题: (1)已知:H2(g)+ H2(g)+O2(g)=H2O2(l)∆H2=-188kJ·mol-1 过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的∆H=_____kJ·mol-1。 (2)100℃时,在不同金属离子存在下,纯过氧化氢24h的分解率见下表:
①由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是____。贮运过氧化氢时,可选用的容器材质为____(填标号)。 |
|||||||||||||||||||||||||
| 17. | 详细信息 |
|
CO和H2是合成气,这两种气体都可以通过CH4通过一定的反应制得。 (1)CH4和CO2反应可以制得CO气体,CH4(g)+3CO2(g) ①a1=___; ②判断T1的T2的大小关系,T1___T2。(填“>”、“<”或“=”) 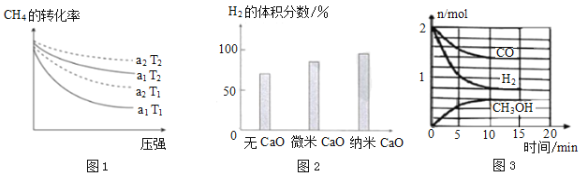 (2)CH4和H2O(g)催化重整可以制取H2和CO2,化学反应为:CH4+2H2O(g) ①投CaO时H2的体积分数增大的原因是___。 ②微米CaO和纳米CaO对H2体积分数的影响不同的原因是___。 (3)生成的CO和H2可用于合成甲醇,其反应为CO(g)+2H2(g) ①初始条件相同时,分别在A(恒温)、B(绝热)两个容器内反应。反应初始时两容器的反应速率A___B(填“>”、“<”或“=”,下同);平衡时CO的转化率A___B。 ②温度T时,在容积为2L的某密闭容器中进行上述反应,反应开始至平衡的相关数据如图3所示。下列能表明该反应已达到平衡状态的是___。 A.v(H2)=2v(CH3OH) B. C.容器中气体的压强不再变化 D. ③该化学反应10min内H2的反应速率v(H2)=___。该温度下,反应的平衡常数为___(保留1位小数)。 |
|
| 18. 实验题 | 详细信息 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
研究发现,大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。碘钟反应是一种化学振荡反应,其体现了化学动力学的原理。某小组同学在室温下对某“碘钟实验”的原理进行探究。 资料:该“碘钟实验”反应分A、B两步进行: 反应A: 反应B: (1)该“碘钟实验”的总反应是___。 (2)为证明反应A、B的存在,进行实验Ⅰ。 a.向K2S2O8溶液中加入试剂X的水溶液,溶液变为蓝色。 b.再向得到的蓝色溶液中加入试剂Y溶液,溶液的蓝色褪去。 试剂X是___、试剂Y是___。 (3)已知A反应的速率方程为: (
①表中V1=__mL,理由是___;
实验过程中,溶液始终无明显颜色变化。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 19. 实验题 | 详细信息 |
|
三氯化碘(ICl3)是一种黄色晶体,遇水易分解,熔点:33℃,沸点:73℃,在药物合成中用途非常广泛。某学习小组从海带中提取碘,并用于制备三氯化碘。 (1)从干海带中提取粗碘 ①写出加入过氧化氢后的反应方程式___。 ②操作Y用到的玻璃仪器有烧杯___,操作Z的名称为___。 (2)利用制得的碘单质制取ICl3  ①仪器a的名称是___。 ②制备氯气选用的药品为高锰酸钾和浓盐酸,相关反应的离子方程式为___。 ③装置B能监测实验进行时装置C中是否发生堵塞,此外还有什么作用___。 ④试剂X为___,X的作用是___。 ⑤氯气与单质碘反应温度稍低于70℃,则装置D适宜的加热方式为___。 |
|