2020陕西高一上学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
在100 mL 0.5 mol/L AlCl3溶液中,加入100 mL NaOH溶液,得到1.56 g沉淀。求NaOH溶液的物质的量浓度。
|
|
| 2. | 详细信息 |
|
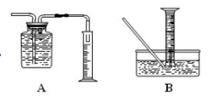
某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了一系列实验。
(1)用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当__时(填实验现象),说明“铁与水蒸气”能够进行反应,写出铁与水蒸气反应的化学方程式____。 (2)为了研究一定时间内铁粉的消耗量,他们设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成的气体体积(已折算成标准状况)。 ①收集并测量气体体积应选图中的__装置。
②称取0.24g铁粉与适量石棉绒混合,然后加热至无气体放出。最好选用__规格的量筒(选填字母序号)。 A.100mL B.200mL C.500mL D.1000mL
|
|
| 3. | 详细信息 |
|
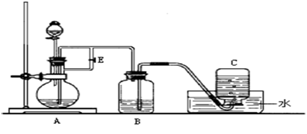
如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6mol/L硫酸溶液,其他试剂任选。填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是__,A中反应化学方程式为__。 (2)实验开始时应先将活塞E__(填“打开”或“关闭”),在C中收到的气体主要为__。 (3)简述生成Fe(OH)2的操作过程__。 (4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:___。
|
|
| 4. | 详细信息 |
|
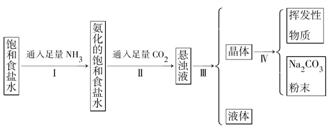
我国化学家侯德榜改革国外的制碱工艺提出的“侯氏制碱法”誉满全球。其生产步骤如图所示:
试完成下列问题: (1)若上述的悬浊液是NaHCO3与NH4Cl的混合物,则Ⅰ和Ⅱ的总反应方程式是__。 (2)由这一反应可知NaCl比NaHCO3溶解度__(填“大”或“小”)。 (3)Ⅲ的操作叫___。 (4)写出Ⅳ的化学方程式___。
|
|
| 5. | 详细信息 |
|
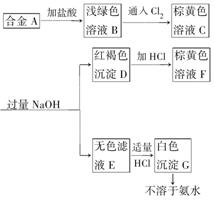
A为两种金属组成的合金,发生如图所示的变化:
试填写以下空白: (1)合金A由___和___组成。 (2)写出下列变化 C→D___;C→E___; E→G___;D→F___。
|
|
| 6. | 详细信息 |
|
铝是一种重要金属: (1)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应 (2)铝还用于冶炼熔点较高的金属如钒、铬、锰等,请配平下列用铝冶炼金属钒的化学反应方程式:V2O5+Al (3)铝与NaOH溶液反应的离子方程式为:___。在同温同压下,等质量铝投入足量盐酸和NaOH溶液中,产生气体的体积之比为___。
|
|
| 7. | 详细信息 |
|
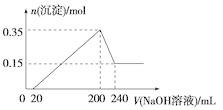
将一定质量的镁和铝混合物投入200 mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示。则下列说法不正确的是( )
A. 镁和铝的总质量为9 g B. 合金与稀硫酸反应生成的氢气体积为10.08 L C. 稀硫酸的物质的量浓度为2.5 mol/L D. 氢氧化钠溶液的物质的量浓度为5 mol/L
|
|
| 8. | 详细信息 |
|
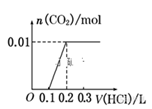
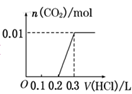
将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( ) A. C.
|
|
| 9. | 详细信息 |
|
下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( ) ①金属钠在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间 ③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用酒精中 A. ②③①④ B. ③②①④ C. ③②④① D. ②③④①
|
|
| 10. | 详细信息 |
|
5.0g金属混合物与足量稀盐酸反应,收集到2.8LH2(标准状况),这种混合物可能的组成是( ) A. Fe和Zn B. Mg和Al C. Fe、Cu、Zn D. Mg、Fe、Cu
|
|
| 11. | 详细信息 |
|
下列金属冶炼的反应原理,错误的是( )。 A. 2NaCl(熔融) B. MgO+H2 C. Fe3O4+4CO D. 2HgO
|
|
| 12. | 详细信息 |
|
把Ba(OH)2溶液滴入明矾(KAl(SO4)2)溶液中,使SO A. Al3+ B. Al(OH)3 C. Al3+和Al(OH)3 D. AlO
|
|
| 13. | 详细信息 |
|
下列可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法及现象是( ) A. 加热时无气体放出 B. 滴加盐酸时有气泡放出 C. 溶于水后滴加BaCl2稀溶液有白色沉淀生成 D. 溶于水后滴加澄清石灰水有白色沉淀生成
|
|
| 14. | 详细信息 |
|
镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有( ) A. AlO2- B. Cu2+ C. Al3+ D. Mg2+
|
|
| 15. | 详细信息 |
|
一定量铁粉放入氯化铁溶液中,完全反应后,得到溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为 A. 1:1 B. 1:2 C. 2:3 D. 3:2
|
|
| 16. | 详细信息 |
|
设NA表示阿伏加德罗常数,下列叙述中正确的是( ) A. 1molNa2O2固体中含离子总数 B. 标准状况下,1.12L氦气所含的原子数为0.1NA C. 1.8gNH4+离子中含有的电子数为NA D. 15.6gNa2O2与过量CO2反应时,转移的电子数为0.4NA
|
|
| 17. | 详细信息 |
|
下列离子方程式书写正确的是( ) A. AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓ B. NaHCO3溶液中加入过量的Ba(OH)2溶液:HCO C. Fe(OH)3溶于HI溶液:Fe(OH)3+3H+=Fe3++3H2O D. 小苏打溶液中加入烧碱溶液:HCO
|
|
| 18. | 详细信息 |
|
常温下,下列各组离子在指定溶液中一定能大量共存的是( ) A. 1.0mol·L-1的KNO3溶液:H+,Fe2+,Cl-,SO B. 石蕊溶液呈红色的溶液:NH C. pH=12的溶液:K+,Na+,CH3COO-,Br- D. 与铝反应产生大量氢气的溶液:Na+,K+,Al3+,NO
|
|
| 19. | 详细信息 |
|
将少量金属钠分别投入下列物质的溶液中,有气体放出,且溶液质量减轻的( ) A. 水 B. 稀盐酸 C. 硫酸钾溶液 D. 硫酸铜溶液
|
|
| 20. | 详细信息 |
|
每次进行焰色反应时,所用铂丝都要用试剂洗涤,这种试剂是( ) A. 稀盐酸 B. 碳酸钠溶液 C. 硫酸 D. 氢氧化钾溶液
|
|
| 21. | 详细信息 |
|
取一小块金属钠,放在燃烧匙里加热,下列实验现象描述正确的是 ①金属先熔化 ②在空气中燃烧,放出黄色火花 ③燃烧后得白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成浅黄色固体物质 A. ②⑤ B. ①②③ C. ①④⑤ D. ④⑤
|
|
| 22. | 详细信息 |
|
在实验室中,通常将金属钠保存在( ) A. 水中 B. 煤油中 C. 四氯化碳中 D. 汽油中
|
|

 B.
B. 
 D.
D. 



