伊宁市2018年高二化学上册期中考试免费试卷完整版
| 1. 选择题 | 详细信息 |
|
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是 ①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 A. ①②③④ B. ④⑤⑥⑦ C. ③⑤⑥⑦ D. ③④⑤⑥⑦ |
|
| 2. 选择题 | 详细信息 |
某化学反应的能量变化如下图所示。下列有关叙述正确的是 A. 该反应的反应热ΔH=E2-E1 B. a、b分别对应有催化剂和无催化剂的能量变化 C. 催化剂能降低反应的活化能 D. 催化剂能改变反应的焓变 |
|
| 3. 选择题 | 详细信息 |
|
下列各组热化学方程式中, ① ② ③ ④ A. ① B. ④ C. ②③④ D. ①②③ |
|
| 4. 选择题 | 详细信息 |
|
下列说法中正确的是 A. 非自发反应在任何条件下都不能实现 B. 自发反应一定是熵增大,非自发反应一定是熵减小 C. 凡是放热反应都是自发的,吸热反应都是非自发的 D. 熵增加且放热的反应一定是自发反应 |
|
| 5. 选择题 | 详细信息 |
|
下列化学反应属于吸热反应的是( ) A. 碘的升华 B. 生石灰溶于水 C. 镁和稀硫酸反应 D. 木炭和二氧化碳反应 |
|
| 6. 选择题 | 详细信息 |
|
对可逆反应4NH3(g)+ 5O2(g) A. 达到化学平衡时,4υ正(O2)= 5υ逆(NO) B. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态 C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 D. 化学反应速率关系是:2υ正(NH3)= 3υ正(H2O) |
|
| 7. 选择题 | 详细信息 |
|
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应: N2(g)+3H2(g)  A. 点a的正反应速率比点b的大 B. 点c处反应达到平衡 C. 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 D. 其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值小 |
|
| 8. 选择题 | 详细信息 |
|
下列事实中,不能用勒夏特列原理加以解释的是 A. 夏天,打开啤酒瓶时会在瓶口逸出气体 B. 浓氨水中加入氢氧化钠固体时产生较多的刺激性气味的气体 C. 压缩氢气与碘蒸气反应的平衡混合气体,颜色变深 D. 将盛有二氧化氮和四氧化二氮混合气的密闭容器置于冷水中,混合气体颜色变浅 |
|
| 9. 选择题 | 详细信息 |
对于反应,N2O4(g) A. ab B. bc C. ac D. ad |
|
| 10. 选择题 | 详细信息 |
|
对于可逆反应A(g)+2B(g) A.  B. B.  C.  D. D.  |
|
| 11. 选择题 | 详细信息 |
|
某温度下,在固定容积的密闭容器中,可逆反应 A(g)+3B(g) A. 平衡向正方向移动 B. 平衡不移动 C. C 的体积分数减小 D. 化学反应速率减小 |
|
| 12. 选择题 | 详细信息 |
|
已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ/mol Na2O2(s)+CO2(g)=Na2CO3(s)+ 根据以上热化学方程式判断,下列说法正确的是 A. CO的燃烧热为283 kJ B. 如图可表示由CO生成CO2的反应过程和能量关系 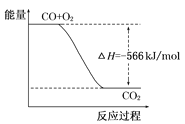 C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 |
|
| 13. 选择题 | 详细信息 |
|
已知热化学方程式:H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 mol·L-1;1/2H2SO4(浓)+NaOH(aq)===1/2Na2SO4(aq)+H2O(l) ΔH2=m,下列说法正确的是 A. 上述热化学方程式中的计量数表示分子数 B. ΔH1>ΔH2 C. ΔH2=-57.3 kJ·mol-1 D. |ΔH1|>|ΔH2| |
|
| 14. 选择题 | 详细信息 |
|
在298 K、1.01×105Pa下,将22 g CO2通入750 mL 1 mol/L NaOH 溶液中充分反应,测得反应放出x kJ的热量。已知在该条件下,1 mol CO2通入1 L 2 mol/L NaOH溶液中充分反应放出y kJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是 A. CO2(g)+NaOH(aq)==NaHCO3(aq) ΔH=-(2y-x) kJ/mol B. CO2(g)+NaOH(aq)==NaHCO3(aq) ΔH=-(2x-y) kJ/mol C. CO2(g)+NaOH(aq)==NaHCO3(aq) ΔH=-(4x-y) kJ/mol D. CO2(g)+2NaOH(l)==2NaHCO3(l) ΔH=-(8x-2y) kJ/mol |
|
| 15. 选择题 | 详细信息 |
|
一定条件下,在一个密闭容器中进行如下反应:NO(g)+CO(g) A. 加催化剂同时升高温度 B. 加催化剂同时增大压强 C. 升高温度同时充入N2 D. 降低温度同时增大压强 |
|
| 16. 选择题 | 详细信息 |
|
一定条件下,在容积为 10L 的密闭容器中,1molX 和 1molY 进行如下反应:2X(g)+Y(g) A. 以 X 浓度变化表示的反应速率为 0.001mol/(L·s) B. 将容器容积变为 20L,Z 的平衡浓度为原来的 1/2 C. 若增大压强,则正反应速率增大,逆反应速率减小 D. 若升高温度,X 的体积分数增大,则该反应的ΔH >0 |
|
| 17. 选择题 | 详细信息 |
|
K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( ) A. 在500℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大 B. 室温下Ka(HCN) < Ka(CH3COOH),说明CH3COOH电离产生的c(H+)一定比HCN电离产生的c(H+)大 C. 25℃时,pH均为4的盐酸和NH4I溶液中KW不相等 D. 2SO2+O2 |
|
| 18. 选择题 | 详细信息 |
|
在由水电离产生的c(H+)=1×10–14mol/L的溶液中,一定可以大量共存的离子组是 A. K+、Ba2+、Cl–、NO3– B. Na+、Ca2+、I–、NO3– C. NH4+、Al3+、Br–、SO42– D. K+、Na+、HCO3–、SO42– |
|
| 19. 选择题 | 详细信息 |
|
用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为V1和V2,则V1和V2的关系正确的是 A. V1>V2 B. V1<V2 C. V1=V2 D. V1≤V2 |
|
| 20. 填空题 | 详细信息 |
(1)某温度时,在 2 L 容器中 X、Y、Z 三种物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式为________ (2)甲烷作为能源燃烧放出大量的热,已知①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)ΔH1=-1214kJ/mol,②2CO(g)+O2(g)=2CO2(g) △H2=-566 kJ/mol则表示甲烷燃烧的热化学方程式为__________________ |
|
| 21. 填空题 | 详细信息 |
|
当温度高于 500 K 时,科学家成功利用二氧化碳和氢气合成了乙醇,这在节能减排、降低碳排放方面具有重大意义。 (1)该反应的化学方程式为________________;其平衡常数表达式为K=________。 (2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是________。 a.体系压强不再改变 b.H2的浓度不再改变 c.气体的密度不随时间改变 d.单位时间内消耗 H2和 CO2的物质的量之比为 3∶1 (3)已知:1 g 氢气完全燃烧生成液态水,放出 143 kJ 热量;23 g 乙醇完全燃烧生成液态水和二氧化碳,放出 650 kJ 热量,则氢气和乙醇的燃烧热的比值为________。(要求计算出数值) (4)在一定压强下,测得由 CO2制取 CH3CH2OH 的实验数据中,起始投料比、温度与 CO2的转化率的关系如图所示,根据图中数据  ①降低温度,平衡向________方向移动。 ②在 700 K、起始投料比 n(H2)/n(CO2)=1.5 时,H2的转化率为________。 ③在 500 K、起始投料比n(H2)/n(CO2)=2 时, 达到平衡后 H2的浓度为a mol·L-1,则达到平衡时 CH3CH2OH 的浓度为________。 |
|
| 22. 填空题 | 详细信息 |
|
现有反应:mA(g)+nB(g) (1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。 (2)减压时,A 的质量分数_________。(填“增大”“减小”或“不变”,下同) (3)若加入 B(体积不变),则 B 的转化率_________。 (4)若 B 是有色物质,A、C 均无色,则加入 C(体积不变)时混合物颜色_______ |
|
| 23. 填空题 | 详细信息 |
在 25mL 的氢氧化钠溶液中逐滴加入 0.2 mol/ L 醋酸溶液,滴定曲线如图所示。 (1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式___________________ (2)该氢氧化钠溶液浓度为______________ (3)在B点,a____12.5mL(填“>”“<”或“=”)。若由体积相等的氢氧化钠溶液和醋酸溶液混合恰好中性,则混合前c(NaOH)____c(CH3COOH),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)____c(OH-)(填“>”“<”或“=”)。 |
|
| 24. 填空题 | 详细信息 |
|
研究NO2、SO2、CO等大气污染气体的处理具有重要。 (1)NO2可用水来吸收,相应的化学反应方程式为:______________________ (2)已知:2SO2(g)+O2(g)=2SO3(g)ΔH=-196.6kJ/mol;2NO(g)+O2(g)=2NO2(g)ΔH=-113.0kJ/mol,则反应NO2(g)+SO2(g)=SO3(g)+NO(g)的ΔH=______kJ/mol。 |
|
| 25. 实验题 | 详细信息 |
草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4—+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)。用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下: (1)写出该反应的离子方程式______________________,该反应中每生成1molCO2 转移电子数为________ 。 (2)如果研究催化剂对化学反应速率的影响,使用实验_______和________(用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验________和_________。 (3)对比实验I和IV,可以研究________对化学反应速率的影响,实验IV中加入1 mL蒸馏水的目的是______________________。 |
|
最近更新



