高二下学期期末考试化学免费试卷完整版(2019-2020年湖北省仙桃、天门、潜江)
| 1. 选择题 | 详细信息 |
|
下列关于化石燃料的加工说法正确的( ) A.石油裂化主要得到乙烯 B.石油分馏是化学变化,可得到汽油、煤油 C.煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气 D.煤制煤气是物理变化,是高效、清洁地利用煤的重要途径 |
|
| 2. 选择题 | 详细信息 |
|
“地球在流浪,环境保护不能忘”,化学与生活、环境、社会发展息息相关。下列说法不正确的是( ) A.有人称“一带一路”是“现代丝绸之路”,丝绸的主要成分是蛋白质 B.聚乳酸酯的降解和油脂的皂化都是高分子生成小分子的过程 C.合成纤维中,维纶吸湿性最好,原因是其分子链上含有羟基 D.工业用乙烯直接氧化法制环氧乙烷体现了“绿色化学”的理念 |
|
| 3. 选择题 | 详细信息 |
|
新冠病毒由蛋白质外壳和单链核酸组成,分子平均直径为60~140nm。下列有关新冠病毒的说法错误的是( ) A.该病毒由C、H、O三种元素组成 B.新冠病毒在空气中可以“气溶胶”形式传播 C.过氧乙酸、75%的乙醇、“84”消毒液等均可有效灭活新冠病毒 D.我国研制的重组新冠病毒疫苗应避光、冷藏保存 |
|
| 4. 选择题 | 详细信息 |
|
下列化学用语正确的是( ) A.NH4Cl的电子式: B.N的电子排布图: C.苯乙烯 D.苯分子的比例模型: |
|
| 5. 选择题 | 详细信息 | ||||||||||||||||||||
下列各有机物的命名或分类不正确的是( )
|
|||||||||||||||||||||
| 6. 选择题 | 详细信息 |
|
已知反应:3A(g)+B(g)=xC(g)+2D(g) △H<0。在容积为1L的恒容密闭容器中加入1molA和1molB;5min时,c(D)=0.1mol•L-1;0~5min内,v(C)=0.2mol•L-1•min-1。 下列叙述正确的是( ) A.5min时,c(A):c(B)=3:5 B.x=2 C.5min时,c(A)=1.25mol•L-1 D.从反应开始到5min内,v(B)=0.05mol•L-1•min-1 |
|
| 7. 选择题 | 详细信息 |
|
NA表示阿伏加德罗常数的值。下列说法正确的是( ) A.1molCsCl晶胞中含有Cl-的数目为8NA B.44g干冰中含有σ键的数目为4NA C.标准状况下,2.24L的CCl4中含有C—Cl键的数目为0.4NA D.17g—OH的质子数与电子数均为9NA |
|
| 8. 选择题 | 详细信息 |
结合图判断,下列说法正确的是( )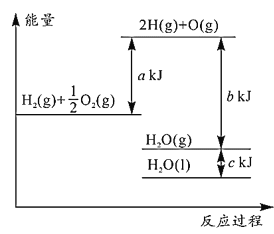 A.1molH2(g)与 B.H2O(g)变为H2O(l)时,断键吸收的能量小于成键放出的能量 C.2molH(g)与1molO(g)生成1molH2O(g)所吸收的热量是bkJ D.液态水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g) △H=2(b+c-a)kJ•mol |
|
| 9. 选择题 | 详细信息 |
|
短周期元素X、Y、Z、W的原子序数依次增大,且四种原子的最外层电子数之和为13;X是原子半径最小的元素,X与W同主族,Z是地壳中含量最高的元素。下列说法不正确的是( ) A.原子半径由大到小的顺序:r(W)>r(Y) >R(Z) B.由元素Z、W形成的化合物中均只含离子键 C.简单气态氢化物的稳定性:Z>Y D.元素Y的简单气态氢化物可以和其最高价氧化物对应的水合物发生反应 |
|
| 10. 选择题 | 详细信息 |
|
“类推”是一种重要的学习方法,但有时会产生错误的结论。下列类推结论中正确的是( ) A.NH3分子中N的杂化方式为sp3,则PH3分子中P的杂化方式也为sp3 B.甲烷的键角是109o28’,白磷(P4)的键角也是109o28’ C.离子晶体中都含有离子键,所以分子晶体中也一定含有共价键 D.干冰(CO2)是分子晶体,则SiO2也是分子晶体 |
|
| 11. 选择题 | 详细信息 | ||||||||||||||||||||
下列实验结论不正确的是( )
|
|||||||||||||||||||||
| 12. 选择题 | 详细信息 |
自从第一次合成稀有气体元素的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。图甲为XeF4的结构示意图,图乙为XeF2晶体的晶胞结构图。下列有关说法错误的是( )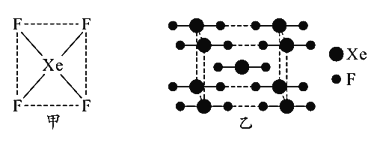 A.XeF4是由极性键构成的非极性分子 B.XeF2晶体属于分子晶体 C.一个XeF2晶胞中实际拥有4个XeF2 D.XeF2晶体中距离最近的两个XeF2之间的距离为 |
|
| 13. 选择题 | 详细信息 |
有机物X、Y、Z在一定条件下可实现如下转化,下列说法正确的是( )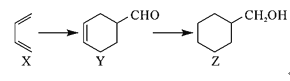 A.Z的六元环上的一氯代物共有3种(不考虑立体异构) B.Y和Z可以用银氨溶液来鉴别 C.X、Y、Z分子中所有碳原子均处于同一平面 D.Y与苯甲醇互为同分异构体 |
|
| 14. 选择题 | 详细信息 | ||||||||||||||||||||
下列有关化学实验的“操作→现象→解释”均正确的是( )
|
|||||||||||||||||||||
| 15. 选择题 | 详细信息 |
我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如图。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述正确的是( )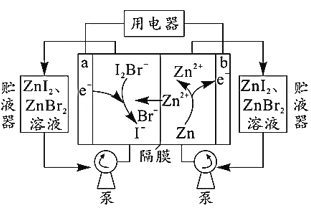 A.放电时,b电极反应式为Zn2++2e-=Zn B.放电时,a电极I-被氧化 C.充电时,导线中每通过0.2mole-,b电极增重6.5g D.充电时,a电极接外电源负极 |
|
| 16. 选择题 | 详细信息 |
常温下,用pH传感器进行数字化实验,分别向两个盛50mL0.1000 mol∙L−1盐酸的烧杯中匀速滴加50mL蒸馏水、50mL0.1000m mol∙L−1醋酸铵溶液,滴加过程进行磁力搅拌,测得溶液pH随时间的变化如图所示。已知常温下醋酸铵溶液的pH=7,下列说法错误的是( )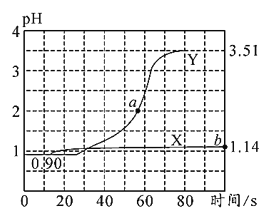 A.曲线X表示盐酸中加水稀释的pH变化,滴加过程中溶液中所有离子的浓度均逐渐减小 B.曲线Y的pH变化主要是因为CH3COO-与H+结合成了弱电解质 C.a点对应的溶液中c(Cl-)+c(CH3COO-)+c(OH-)-c( D.b点对应的溶液中水电离的c(H+)=10−12.86 mol∙L−1 |
|
| 17. 填空题 | 详细信息 |
|
1869年,俄国化学家门捷列夫提出了元素周期律,并在此基础上发表了第一张元素周期表。为了纪念元素周期表诞生150年,联合国将2019年定为“国际化学元素周期表年”,并认为元素周期表是“科学共同的语言”。 (1)认识元素周期表的结构: 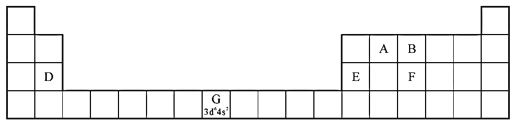 ①在元素周期表中,第ⅠB、ⅡB元素属于____区。 ②2017年5月9日我国发布了113号Nh、115号Mc、117号Ts、118号Og四种元素的中文名称,分别为“ a.115号元素在周期表中的位置是第七周期VB族 b.117号元素Ts位于金属与非金属分界线上,属于准金属,可能是半导体 c.这四种元素都是主族元素 d.最高价氧化物的水化物的碱性:Nh>Mc (2)认识原子结构与元素周期表的关系:见表中元素G的信息,其中“3d64s2”称为该元素原子的___,该元素M能层上具有____种不同运动状态的电子。 (3)认识元素周期律及其应用: ①第三周期元素的第一电离能:D___E(填“>”“<”或“=”)。 ②气态氢化物的沸点:B___F(填“>”“<”或“=”),理由是___。 |
|
| 18. 实验题 | 详细信息 | ||||||||||||||||
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如图(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr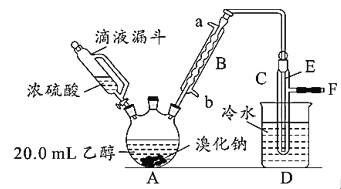 有关数据见表:
|
|||||||||||||||||
| 19. | 详细信息 |
“富煤、贫油、少气”是我国能源发展面临的现状,随着能源的日益紧张,发展“煤化工”对我国能源结构的调整具有重要意义。图1是煤化工产业链之一。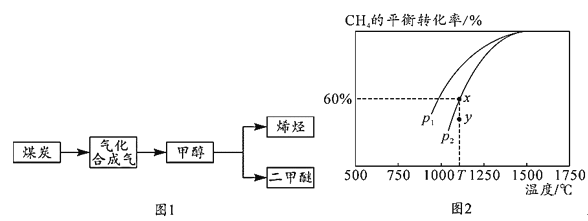 “洁净煤技术”研究在世界上相当普遍,科硏人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出热值很高的煤炭合成气,其主要成分是CO和H2,CO和H2可作为能源和化工原料,应用十分广泛。 (1)已知: Ⅰ.C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol Ⅱ.C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3kJ/mol 则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H=___kJ/mol。 (2)在T1℃时,体积为1L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应:CO(g)+2H2(g) ①下列情形能说明上述反应已达到平衡状态的是__(填字母序号)。 a.体系压强保持不变 b.密闭容器中CO、H2、CH3OH(g)三种气体的物质的量相等 c.体系内的密度保持不变 d.每消耗1molCO的同时生成2molH2 ②当起始 (3)已知CO2(g)+CH4(g) |
|
| 20. | 详细信息 |
有机物M常作消毒剂、抗氧化剂等,用芳香烃A制备M的一种合成路线如图: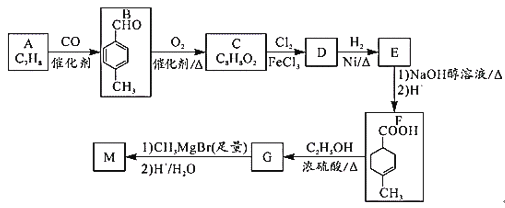 已知:R1COOR2 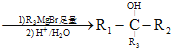 请回答下列问题: (1)D中官能团的名称为____。 (2)C生成D的反应类型为____。 (3)E与足量氢氧化钠的乙醇溶液反应的化学方程式为___。 (4)芳香族化合物H与C互为同分异构体,且能发生水解反应和银镜反应,H的结构共有___种;写出其中核磁共振氢谱有4组峰,且峰面积之比为1:2:2:3的物质的结构简式:___。 (5)参照上述合成路线和信息,以苯甲酸甲酯和CH3MgBr为原料(无机试剂任选)设计制备  的合成路线。__ 的合成路线。__ |
|
| 21. | 详细信息 |
|
过渡元素在工业、农业、科学技术以及人类生活等方面有着重要作用。请回答下列问题: (1)基态Cu原子的核外电子排布式为__。 (2)高密度磁记录材料纳米钴(Co)可通过亚肼(N2H2)还原氯化亚钴来制备。 ①N2H2分子中氮原子的杂化形式为___。 ②亚肼(N2H2)分子中四个原子在一个平面上,由于几何形状的不同,它有两种同分异构体 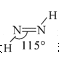 和 和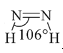 ,乙炔(C2H2)与亚肼(N2H2)均为四原子分子,但乙炔(C2H2)分子只有一种结构,原因是__。 ,乙炔(C2H2)与亚肼(N2H2)均为四原子分子,但乙炔(C2H2)分子只有一种结构,原因是__。③Co3+能与NH3和N (3)FeO、NiO晶胞结构相同,晶体中r(Ni2+)和r(Fe2+)分别为69pm和78pm,则熔点:NiO___FeO(填“>”或“<”),原因是___;已知NiO晶体结构中阴、阳离子的配位数均为6,则NiO晶胞的俯视图可能是__(填字母序号)。 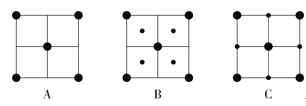 (4)CdS的立方晶胞结构如图所示,已知阿伏加德罗常数的值为NA,该晶胞的晶胞参数为apm,该晶体的密度为ρg/cm-3,则Cd原子的相对原子质量的数值近似为___(用含ρ、NA、a的代数式表示)。 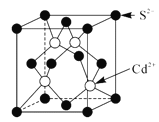 |
|
- 2017-2018年高一上学期第二次月考化学考题带答案和解析(河南省商丘市第一高级中学)
- 2017届高一上第三次月考化学试卷(安徽省淮北一中)
- 高中化学人教版 选修三 第3章 晶体结构与性质 金属晶体的原子堆积模型
- 2017-2018年高二12月月考化学考卷带参考答案和解析(安徽省铜陵市第一中学)
- 2017,2018年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
- 高中化学人教版 选修三 第3章 晶体结构与性质 分子晶体
- 2018届高三上学期第四次检测理综化学在线测验(四川省南充高级中学)
- 2018年至2019年高一上期第一次半月考化学考试(云南省曲靖市会泽县一中)



