2017-2018年高一12月月考化学试卷(江苏省泰州中学)
| 1. | 详细信息 |
|
化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用。下列做法与社会可持续发展理念相违背的是 A. 回收利用废旧金属 B. 加强植树造林,增大绿化面积 C. 大力开发不可再生资源 D. 改进汽车尾气净化技术 |
|
| 2. | 详细信息 |
|
除去镁粉中少量的铝粉,最适宣的试剂是 A. NaOH溶液 B. AgNO3溶液 C. 氨水 D. 盐酸 |
|
| 3. | 详细信息 |
|
关于氯水说法正确的是 A、新制氯水中只含有Cl2、H2O分子 B、新制氯水可使蓝色石蕊试纸先变红后褪色 C、光照氯水有气泡冒出,该气体是主要是氯气 D、氯水久置后,溶液内与原来相比Cl-浓度保持不变 |
|
| 4. | 详细信息 |
|
硅是带来人类文明的重要元素之一。下列物质中主要成分是硅酸盐的是 A. 陶瓷 B. 金刚石 C. 光导纤维 D. 大理石 |
|
| 5. | 详细信息 |
|
下列各种冶炼方法中,可制得相应金属的为 A.高温分解碳酸钙 B.电解熔融氯化镁 C.氧化铝和焦炭混合加热 D.电解饱和食盐水 |
|
| 6. | 详细信息 |
|
下列关于SO2的说法中,不正确的是 A.SO2能使品红溶液褪色,是因为SO2具有漂白性 B.SO2在空气中极易被氧化为SO3 C.SO2通入Na2SO3或NaHCO3溶液中均能发生反应 D.SO2是形成酸雨的大气污染物之一,主要来自于化石燃料的燃烧和工厂排放的废气 |
|
| 7. | 详细信息 |
|
下列变化中,必须加入氧化剂才能发生的是 A. SO2→S B. Cl2→HClO C. Fe2+→Fe3+ D. HCO3-→CO32- |
|
| 8. | 详细信息 |
|
下列有关于Cl2的说法中,错误的是 A. Cl2是一种黄绿色、密度比空气大的有毒气体 B. 红热的铁丝在Cl2中剧烈燃烧,产生白色烟雾 C. 工业上用Cl2和石灰乳为原料制造漂白粉 D. Cl2能与水反应生成盐酸和次氯酸 |
|
| 9. | 详细信息 |
|
下列实验装置、试剂选用或操作正确的是 A.  干燥Cl2 B. 干燥Cl2 B. 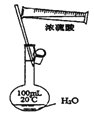 稀释浓硫酸 C. 稀释浓硫酸 C.  称量NaOH D. 称量NaOH D. 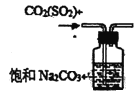 用于除去CO2中的少量SO2 用于除去CO2中的少量SO2 |
|
| 10. | 详细信息 |
|
设NA为阿伏加?罗常数的值,下列说法正确的是 A. 常温常压下,16gO3中含氧原子数为NA B. 7.1gCl2与足量NaOH反应转移的电子数为0.2NA C. 0.1mol?L-1 Na2CO3溶液中含钠离子数为0.2 NA D. 标准状况下,2.24 L水中含氧原子数为0.1NA |
|
| 11. | 详细信息 |
|
化学在生产和日常生活中有着重要的应用。下列说法不正确的是 A. 明矾在水中形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 B. SiO2是良好的半导体材料,常用于制造计算机的芯片 C. Fe2O3俗称铁红,常用作红色的油漆和涂料 D. Cl2可用于自来水的杀菌消毒 |
|
| 12. | 详细信息 |
|
下列说法不正确的是 A. 要想使AlCl3溶液中的Al3+几乎全部沉淀出来,可以加入过量的氨水 B. 向FeCl2溶液中加入氨水,最终会看到红褐色沉淀 C. 漂白粉的有效成分是次氯酸钙 D. 氢氧化钠、纯碱溶液要存放在带磨砂玻璃塞的试剂瓶中 |
|
| 13. | 详细信息 |
|
某无色溶液能与铝作用生成H2,则溶液中一定可以大量共存的离子组是 A. Cl-、Ba2+、Mg2+、ClO- B. Cl-、SO42-、Cu2+、Mg2+ C. Cl-、SO42-、K+、Na+ D. HCO3-、NO3-、Na+、Cl- |
|
| 14. | 详细信息 |
|
将适量铜粉放入硫酸铁溶液中,完全反应后,溶液中的Cu2+和Fe3+的物质的量浓度相等,则已反应的Fe3+和原溶液中Fe3+总物质的量之比是 A.2 :3 B.3 :2 C.2 :5 D.1 :2 |
|
| 15. | 详细信息 |
|
向一定量的Fe、Fe2O3的混合物中,加入300mL1mol?L-1的盐酸,恰好使混合物完全溶解,放出672 mL (标准状况)的气体。所得溶液中,加入KSCN溶液无血红色出现,那么若用足量的CO在高温下还原相同质量的此混合物,能得到铁 A. 2.8g B. 5.6g C. 8.4g D. 无法确定 |
|
| 16. | 详细信息 |
|
通过化合反应可以得到的物质有 A. FeCl2 B. Fe2O3 C. Al(OH)3 D. Fe(OH)3 |
|
| 17. | 详细信息 |
|
下列离子方程式书写正确的是 A. 氯气和水反应:Cl2+H2O=2H++Cl-+ClO- B. 腐蚀铜制印刷电路板:3Cu+2Fe3+=3Cu2++2Fe C. 过量SO2气体通入澄?石灰水中:SO2+OH-=HSO3- D. 向水玻璃中滴加盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+ |
|
| 18. | 详细信息 |
|
以下物质间的每步转化能通过一步反应就能实现的是 A. Al2O3→Al(OH)3→NaAlO2 B. Si→SiO2→H2SiO3 C. S→SO2→H2SO4 D. HCl→Cl2→FeCl2 |
|
| 19. | 详细信息 | |||||||||||||||
下列实验操作与预期实验目的或所得实验结论一致的是
|
||||||||||||||||
| 20. | 详细信息 |
|
向含溶质0.2mol的Al2(SO4)3溶液中加入1000mL? KOH溶液,生成白色沉淀7.8g ,则KOH溶液的物质的量浓度可能为 A.0.3mol/L ? B.0.7mol/L C.0.8 mol/L ?D.1.5mol/L |
|
| 21. | 详细信息 |
|
Ⅰ.已知2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑ (1)氧化剂与还原剂的物质的量之比是_________,HCl在反应中表现的性质有____________。 (2)单线桥标明该反应电子转移方向和数目:________________________。 (3)写出以软锰矿为原料制备Cl2的化学方程式___________________。 Ⅱ.(1)VLFe2(SO4)3溶液中含Fe3+ag,则该溶液中溶质的物质的量浓度为______________。 (2)为了供学生课外活动,要求把SO42-、CO32-、H+、OH-、NH4+、Fe3+、Na+七种离子根据共存原理分为两组混合溶液,分配结果是: 第一组:_______________;第二组:______________________。 |
|
| 22. | 详细信息 |
已知A、C均为银白色金属单质,B为黑色磁性金属氧化物,它们之间的转化关系如下图(部分反应物和生成物省略),请回答下列问题: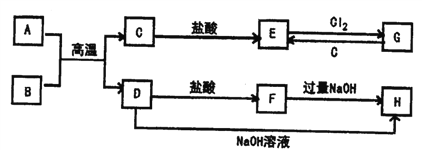 (1)写出B的化学式__________________、H的化学式______________ (2)写出A与B反应的化学方程式_____________________ 写出D+NaOH→H的化学方程式_____________________ 写出G+C→E的离子方程式______________________ |
|
| 23. | 详细信息 |
某兴趣小组模拟工业制漂白粉,设计了如下图所示的实验装置。己知:①氯气和碱反应放出热量。②6Cl2+6Ca(OH)2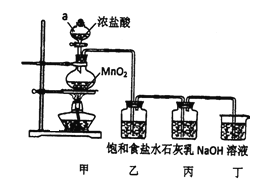 回答下列问题: (1)甲装置中仪器a的名称是_________________,MnO2在反应中所起的作用是_____________。 (2)装置乙中饱和食盐水的作用是_________________。 (3)①制取漂白粉的化学方程式是____________________。 ②该小组制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2],其主要原因是____________________。 ③为提高Ca(ClO)2的含量,可采取的措施是___________________(任写一种即可)。 (4)漂白粉应密封保存,原因是__________、_________________(用化学方程式表示)。 |
|
| 24. | 详细信息 |
工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4?7H2O),流程如下: (1)滤渣I的主要成分是_______________(填化学式)。 (2)还原时,试剂X若选用SO2,则反应后溶液中的阴离子是_________________(填化学式) (3)检验过滤Ⅰ得到的滤液中存在Fe3+的方法是____________________。 (4)七水合硫酸亚铁(FeSO4?7H2O)在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。 步骤a:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成250mL溶液; 步骤b:取上述溶液25 mL于锥形瓶中,加入少量稀硫酸酸化后,逐渐滴加0.0100 mol/L的KMnO4溶液,至恰好完全反应,记录消耗的KMnO4溶液的体积(假定药品中其他成分不与KmnO4反应),发生的反应为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O; 步骤c:重复“步骤b”2~3次,平均消耗KMnO4溶液20.00mL。 ①步骤a中配制溶液时需要的玻璃仪器除烧杯、胶头滴管外,还需要___________、________。 ②该补血剂中亚铁离子的含量为mg/片(请写出计算过程) ___________。 |
|
最近更新



