2016四川高三下学期人教版高中化学开学考试
| 1. | 详细信息 |
|
化学与生产、生活密切联系。下列有关说法不正确的是 A.网状结构的聚丙烯酸钠是高吸水性树脂,可用于制造“尿不湿” B.光导纤维应避免在强碱性环境中使用 C.利用超临界C02流体作为萃取溶剂符合绿色化学 D.船体镀锌或锡均可保护船体,镀层破损后将立即失去保护作用 |
|
| 2. | 详细信息 |
|
设NA为阿伏伽德罗常数的值。下列说法正确的是 A .l mol H20最多可形成氢键数目为2NA B.标准状况下,11.2 L甲醛所含的G键数目为2NA C.常温下,46 g N02所含分子数目为NA D. pH=l的硫酸中所含S042-的数目为0.05NA |
|
| 3. | 详细信息 |
|
下列各离子反应方程式书写正确的是 A.配制银氨溶液时的总反应: Ag++3NH3·H20=[Ag(NH3)2]OH+NH4'+++2H20 B.向1 mL 0.l mol/L硝酸亚铁溶液加入1 mL 0.1 mol 3 Fe2++N03-+4H+=3 Fe3++NO +2 H2O C.向10 mL 0.lmol/L NH4Al(SO4) D. 向高锰酸钾酸性溶液中滴加H202溶液,高锰酸钾溶液紫红色褪去: 2MnO4-+7H2O2+6H+=2Mn2++6O2+lOH2O |
|
| 4. | 详细信息 |
|
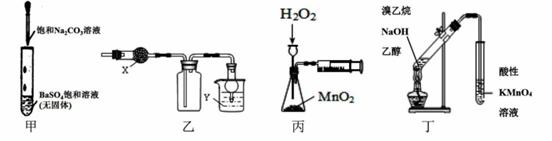
利用下列实验装置能达到相应实验目的的是
A.甲可用于研究沉淀的转化,可比较出Ksp(BaSO4>Ksp(BaCO3) B.乙中X为无水CaCI2,Y为NaOH溶液时,该装置可用于SO2的收集 C.丙装置可定量测定H2O2的分解速率 D.丁可用于证明实验中生成了乙烯 |
|
| 5. | 详细信息 |
|
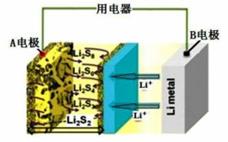
如图为某高效锂硫电池。关于该电池的说法正确的是 A.电子流向:B电极→用电器→A电极→电解质→B电极 B.A电极上发生的一个电极反应为:2Li++S8+2e一=Li2S8 C.若用该电 D.若用该电池电解精炼铜,负极减少7g时阳极减少质量为32 g
|
|
| 6. | 详细信息 |
|
己知:下表为25℃时某些弱酸的电离平衡常数。
右图表示常温下,稀释CH3COOH、HC10两种酸的稀溶液时,溶液 pH随加水量的变化。下列说法不正确的是 A.图中c(H+):c(R-)的值:a点>c点(HR代表CH3COOH或HCIO) B. pH相同的四种溶液浓度关系:c(CH3COONa>c(NaHC03>c(NaClO>c(Na2C03) C.图中a点酸的总浓度小于b点酸的总浓度 D.浓度均为0.l mol/L的CH3COONa和NaCIO的混合溶液中: c(OH-)=0.l mol/L-c(ClO-)+c(H+)+c(CH3COOH) |
|
| 7. | 详细信息 |
|
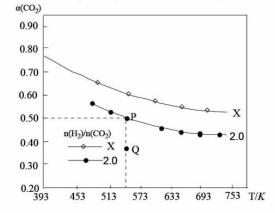
在两个固定容积均为1L密闭容器中以不同的氢碳比[n(H2)/n(C02)]充入H2和C02,在一定条件下发 生反应:2C02(g)+6H2 (g)
A.该反应在高温下自发进行 B.氢碳比:X<2.0 C.氢碳比为2.0时.Q点v(H2)逆小于P点的v( D.向处于P点状态的容器中,按2:4:1:4的比例再充入 C02、H2、C2H4. H20,再次平衡后a(C02)减小
|
|
| 8. | 详细信息 |
|
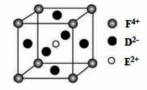
A、B、C、D、E、F是前四周期原子序数依次增大的六种元素。A元素原子的核外电子数等 于其电子层数,B元素基态原子有三个能级且各能级电子数相同, G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之 和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域。请回 答下列各题(涉及元素请用相应化学符号表示): (1)B、C、D中第一电离最大的元素其基态原子有 种不同能量的电子。 (2)G分子中D原子的杂化方式为____,F2+的基态价电子排布式为____。
(4)某化合物晶胞结构如右图所示, E2+的配位数是 。 (5)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子。 ①释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因是 。 ②由H分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与S02的水溶液反应 的离子方程式 ;该阳离子还能与H分子作用生成羟基,经测定此时的H 具有酸性,写出该过程的离子方程式 。 |
|
| 9. | 详细信息 |
|
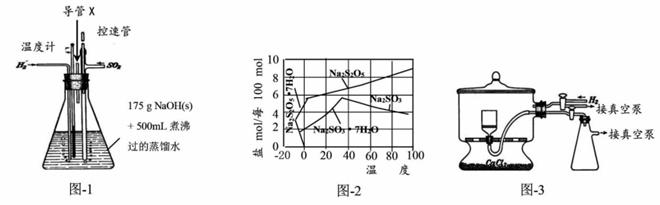
食品加工中常用焦亚硫酸钠(Na2S205)作漂白剂、防腐剂和疏松剂。 现在实验室制备焦亚硫酸钠,其反应依次为: (ii)Na2S03+ H20+S02=2NaHS03; (iii)2NaHS03 查阅资料:焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化。 实验装置如下:
(l)实验室可用废铝丝与NaOH溶液制取H2,其离子方程式为____。 (2)通氢气一段时间后,以恒定速率通入S02, 变化,溶液开始逐渐变黄。“温度迅速升高”的原因为________。 实验后期须利用水浴使温度保持在约80℃。 (3)反应后的体系中有少量白色亚硫酸钠析出,除去其中亚硫酸钠固体的方法是____; 然后获得较纯的无水Na2S205应将溶液冷却到30℃左右过滤,控制“30℃左右”的理由是____。 (4)图.3为真空干燥Na2S205晶体的装置,通入H2的目的是____。 (5)常用剩余碘量法测定产品中焦亚硫酸钠的质量分数。已知:S2052 -+2I2+3H20=2S042~+4I一+6H+; 2S2032-+I2=S4062-+2I一。请补充实验步骤(可提供的试剂有:焦亚硫酸钠样品、标准碘溶液、淀粉溶 液、酚酞溶液、标准Na2S203溶液及蒸馏水)。 ①精确称取产品0.2000 g放入碘量瓶(带磨口塞的锥形瓶)中。 ②准确移取一定体积的已知浓度的标 5 mL冰醋酸及适量的蒸馏水。 ③用标准Na2S203溶液滴定至接近终点。 ④____。 ⑤重复步骤①~④;根据相关记录数据计算出平均值。 |
|
| 10. | 详细信息 |
|
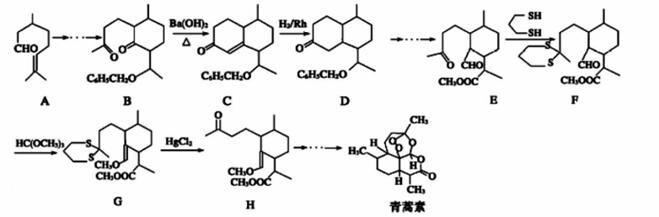
2015年我国药物化学家屠呦呦因抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医 学奖。青蒿素的一种化学合成方法部分工艺流程如图:
己知:
(1)化 (2)该方法设计E→F→G→H的目的是 。 (3) B-→C的反应实际可看作分两步进行,则涉及的反应类型依次为________。 (4)检验A中醛基的方法是 (5)A在H2/Rh条件下反应后的产物的名称为 ;该产物的一种同分异构体 X满足下列要求:①分子中含六元环;②不能与金属钠反应;③核磁共振氢谱显示有四组峰,则X的 结构简式为 (任写一种)。 (6)H与稀硫酸共热时反应的化学方程式为____。 |
|
| 11. | 详细信息 |
|
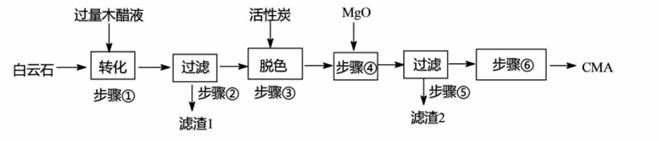
冬日,雪花漫舞,给人带来美的享受,但降雪却会导致道路通行问题。现有一种高速公路 的绿色融雪剂-CMA(醋酸钙、醋酸镁固体的混合物),其生产常以白云石(主要成分 MgC03·CaC03,含Si02等杂质)和生物质废液——木醋液(主要成分乙酸,以及少量的 酚、焦油等杂质)等为原料,流程如下:
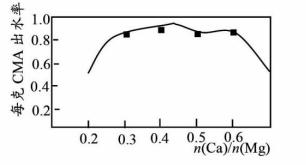
(1 (2)滤渣1的主要成分与NaOH溶液反应的热化学方程式为 (己知l mol NaOH发生反应时放出热量为QkJ);步骤②所得滤液常呈褐色,分析可知其原因主要是
(3)已知CMA中钙、镁的物质的量之比与出水率(与融雪 效果成正比)关系如右图所示,步骤④的目的除调节 n(Ca):n(Mg) 约为____ (选填:1:3; 1:2; 3:7; 2:3) 外,另一目的是 。 (4)步骤⑥包含的操作有____ 、过滤、洗涤及干燥。 (5)取akg含MgC03 过上述流程制备CMA。已知MgC03'·CaC03的损失率为 c%,步骤④之后到产品CMA的损失率为d%, 则结合(3)可知所得产品质量约为_ kg(请用含相关字母的计算式表达,不必化简)。 |
|