2020北京人教版初中化学专题练习
| 1. | 详细信息 | |||||||||
|
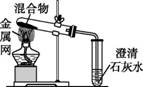
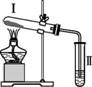
为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5 g进行系列实验。 【查阅资料】①氧化铜(CuO)为黑色固体。 ②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4 【进行实验】 实验1:取质量比1∶11的木炭粉和氧化铜混合物1.3 g,进行实验。
【解释与结论】 (3)实验1的目的是 。
|
||||||||||
| 2. | 详细信息 | ||||||||||||||||||||
|
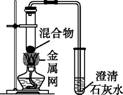
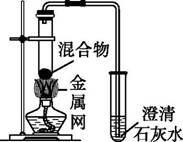
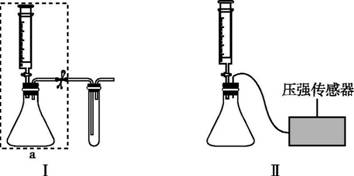
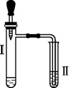
为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5 g进行系列实验。 【查阅资料】 ①氧化铜(CuO)为黑色固体。 ②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4 【进行实验】 实验2:取一定量的混合物,用图所示装置进行实验。
【解释与结论】 (4)实验2的结论是 。
|
|||||||||||||||||||||
| 3. | 详细信息 | ||||||||||||||||
|
同学们在实验室用图所示装置制取氧气。
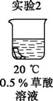
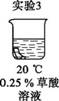
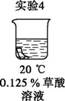
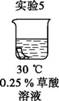
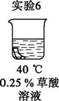
【查阅资料】 草酸溶液能将棕褐色物质除去。 【提出问题】 哪些因素能加快草酸除去棕褐色物质的速率? 【进行实验】 将均匀染为棕褐色的抹布剪成大小相同的小布条进行实验。
【解释与结论】 (4)证明升高温度能加快草酸除去棕褐色物质的速率,需要对比 (填实验序号)。 (5)由实验2、3、4可以得出的结论是 。
|
|||||||||||||||||
| 4. | 详细信息 | ||||||
|
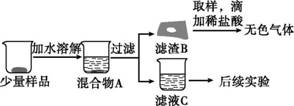
实验课上,某小组的同学用生石灰进行“化学反应中能量的变化”实验时发现:向块状生石灰中加入适量水后没有明显的温度变化。为确定其原因,进行了如下实验探究。 【提出问题】生石灰是否变质?其成分是什么? 【查阅资料】氢氧化钙溶解过程中无明显温度变化,与盐酸反应无气体生成。 【猜想与假设】同学们认为生石灰样品已经变质,并对其成分作出了如下4种猜想。 猜想1:氧化钙和氢氧化钙; 猜想2:氧化钙和碳酸钙; 猜想3:氢氧化钙和碳酸钙; 猜想4:氧化钙、氢氧化钙和碳酸钙。 【进行实验】同学们将少量样品研碎后,按如图T5-8所示过程进行实验。
图T5-8 (1)在溶解过程中用温度计测量液体的温度,发现温度计示数升高,说明样品中应该含有氧化钙。结论:猜想3不成立。 (2)滤渣B中一定含有碳酸钙。结论:①块状生石灰表面发生变质;②猜想1不成立。 (3)为验证滤液C的成分,进行后续实验。
【反思与评价】上述实验过程能否得出猜想4成立、猜想2不成立的结论,并说明理由: 。
|
|||||||
| 5. | 详细信息 | ||||||||||||||||||||||||||||
|
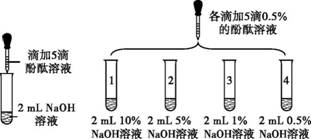
众所周知,酚酞溶液遇NaOH溶液变红。但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物。
【提出问题】分组实验中,出现意想不到现象的原因是什么呢? 【查阅资料】酚酞溶液由酚酞固体溶于酒精配制而成。 【猜想与假设】 Ⅰ.红色褪去,与NaOH溶液和空气中的CO2反应有关。 Ⅱ.红色褪去,与NaOH溶液的浓度有关。 Ⅲ.出现白色浑浊物,与酚酞溶液的浓度有关。 【进行实验】
【解释与结论】 (1)NaOH与CO2反应的化学方程式为 。 (2)实验1的现象表明,猜想与假设Ⅰ (填“成立”或“不成立”)。 (3)由实验2得出结论:出现“溶液变红后褪色”现象的原因是 。 (4)实验3的操作步骤:取3支试管,分别加入2 mL水, 。 【反思与评价】 (5)依据现有实验,为了确保红色不变,若酚酞溶液浓度为0.5%,建议选用NaOH溶液的浓度为 %。 (6)有同学认为,仅通过实验3得出“猜想与假设Ⅲ成立”证据不足,理由是 。
|
|||||||||||||||||||||||||||||
| 6. | 详细信息 | ||||||||||||||||||||||||||||||||||
|
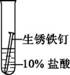
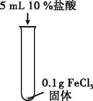
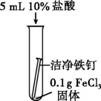
兴趣小组用稀盐酸除去铁钉表面的铁锈(主要成分是Fe2O3),发现反应开始时铁锈消失,有气泡产生,溶液颜色为黄色,一段时间后变为浅绿色。
【查阅资料】FeCl3的溶液呈黄色。 甲同学认为生成的FeCl3可能与试管中的物质继续反应,进行了下列实验。
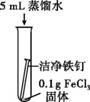
(1)用盐酸除铁锈的化学方程式为 。 (2)实验1-1的目的是 。 (3)综合分析实验1,溶液从黄色变浅绿色的可能原因是 。 乙同学用生锈程度相同的锈铁钉、5 mL盐酸探究溶液颜色变化的影响因素。
(4)生锈铁钉与盐酸反应时,溶液的颜色变化与 有关。 (5)实验2-2中始终未观察到溶液变黄色,结合实验1和实验2推测可能的原因为 。 (6)基于上述实验推测,下列关于工业用盐酸除铁锈的说法合理的是 (填序号)。 A. 除铁锈时,所用盐酸的浓度越大越好 B.在除锈过程中,生成的FeCl3对铁也有腐蚀作用 C.用盐酸除锈时,应注意控制反应的时间
|
|||||||||||||||||||||||||||||||||||
| 7. | 详细信息 |
|
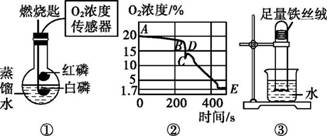
化学小组利用图 ①所示装置探究物质在空气中燃烧后氧气浓度的变化。 (已知:白磷着火点为40 ℃,红磷着火点为240 ℃)
【提出问题】足量红磷燃烧熄灭后,烧瓶内是否有氧气剩余? 【猜想假设】 猜想1:有氧气剩余; 猜想2:无氧气剩余。 【进行实验】 步骤Ⅰ.组装仪器,检查装置的气密性。 步骤Ⅱ.用高能激光笔照射燃烧匙中足量的红磷。红磷燃烧,一段时间后熄灭;白磷始终不燃烧。 步骤Ⅲ.冷却。 步骤Ⅳ.将装有白磷的燃烧匙提出水面,用高能激光笔照射,白磷燃烧。 【解释与结论】 (1)高能激光笔的作用是 。 (2)步骤Ⅱ中,白磷不燃烧的原因是 。 (3)图②是用传感器测量整个实验过程中烧瓶内氧气浓度变化的曲线。图②中 (填字母序号)点表示燃烧的红磷刚好熄灭,DE段氧气浓度变化的主要原因是 。 【反思与评价】 (4)通过探究可知,课本上用“红磷燃烧测定空气中氧气含量”的方法不够严谨,其理由是 。 (5)查阅资料可知,测定空气中氧气含量较好的药品是铁丝绒,利用的原理是铁与氧气、水发生缓慢氧化。用图③所示装置完成测定空气中氧气含量的实验,最终观察到的现象是 。
|
|
| 8. | 详细信息 | ||||||||||||||||||||||||||||||||||||||||||
|
食品包装中常有一小包干燥剂(或双吸剂),课外小组的同学对它们产生了浓厚的兴趣,对生活中的干燥剂进行探究。 【查阅资料】 (1)包装中常用的干燥剂
(2)实验室常用氢氧化钠和浓硫酸作干燥剂。生活中很少用浓硫酸作干燥剂的原因是 (至少写出一点)。 【进行实验】同学们进行了下列两组实验: 实验Ⅰ:比较几种干燥剂的干燥能力。按图 所示进行实验,实验结果如下表:
实验Ⅱ:探究几种干燥剂的干燥效率。分别取下列干燥剂各15 g 平铺在培养皿底部,按图所示进行实验,实验结果如下表:
【解释与结论】 (1)实验Ⅰ中,比较几种干燥剂干燥能力强弱的依据是 。 (2)10 g氯化钙最大吸水量是12 g,吸水后,形成氯化钙溶液,该溶液中溶质的质量分数为 (计算结果保留至0.1%)。 (3)实验Ⅱ中,还必须控制的变量是 。 (4)实验Ⅱ得出的结论是 。 【反思与评价】小明认为实验Ⅰ的设计存在问题,他所说的问题应该是 。
|
|||||||||||||||||||||||||||||||||||||||||||
| 9. | 详细信息 | ||||||||||||||||||||
|
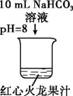
同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应。 (1)实验准备 ①查阅资料:NaHCO3+NaOH ②用一定溶质质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如下实验,为设计实验方案提供参考。
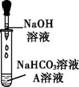
表中的现象Ⅰ为 ,现象Ⅱ对应反应的化学方程式为 。 (2)实验过程 【实验1】证明反应生成了Na2CO3。 同学们选用上表实验中的药品,设计了如图所示实验,先在NaHCO3溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是 。
有同学提出这个实验不足以证明有Na2CO3生成,其理由是 。为了证明有Na2CO3生成,需要继续进行的操作是 。 【实验2】证明反应后NaHCO3不存在。 同学们参考上表中的实验,又设计了一个实验,虽然没有观察到明显的实验现象,但可以证明反应发生了,该实验方案是 。 (3)实验反思 通过实验1和实验2说明,对于没有明显现象的化学反应,可以从两个不同的角度证明反应的发生,这两个角度是 。
|
|||||||||||||||||||||
| 10. | 详细信息 | ||||||||||
|
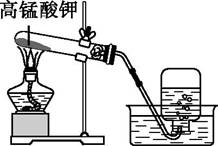
高锰酸钾在生产、生活中有广泛应用。实验小组对高锰酸钾的某些性质进行研究。 【查阅资料】KMnO4 溶液呈中性、有腐蚀性。 【进行实验】 实验1:将新鲜鸡皮在不同浓度的KMnO4溶液中浸泡相同时间,现象如下表。
【解释与结论】 (3)实验1的目的是 。
|
|||||||||||
| 11. | 详细信息 | |||||||||||||||
|
酱油在使用及储藏过程中颜色会变深,逐渐降低品质。实验小组通过实验研究温度、氧气、光照3个因素对酱油颜色的影响。 【查阅资料】①通过色差仪检测L*值可监控酱油颜色变化,酱油颜色越深,L*值越小。 ②保鲜瓶具有的特点是挤出盛放的物质后,空气不会进入。 【实验准备】 将等量样品(同品牌、同批次、初始L*值为43.82的酱油)分装到500 mL的不同容器中,密封。 【进行实验】 实验2:将装有样品的两个容器置于28 ℃的恒温箱中。每15天,分别倒出100 mL酱油,剩余样品放回恒温箱。用色差仪检测倒出样品的L*值,结果如下。
【解释与结论】 (2)实验2的目的是 。
|
||||||||||||||||
| 12. | 详细信息 | ||||||||||||||||||||||||||||||||
|
兴趣小组同学尝试用红心火龙果汁、发酵粉和面粉制作“紫红色花卷”。蒸熟后,却发现花卷变成了黄色。对此进行探究。
【查阅资料】 ①红心火龙果汁含天然色素,呈紫红色,受热易分解。 ②发酵粉主要成分是碳酸氢钠,受热分解生成碳酸钠、水和二氧化碳。 【猜想与假设】 Ⅰ.紫红色花卷变黄与温度升高有关; Ⅱ.紫红色花卷变黄与发酵粉有关。 实验1:探究影响紫红色花卷变黄的因素。
(3)综合实验1,能得出的结论是 。 实验2:继续探究实验1-3中花卷变黄的原因。
(5)综合实验2,能得出的结论是 。
|
|||||||||||||||||||||||||||||||||
| 13. | 详细信息 | ||||||||||||||||||
|
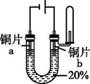
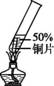
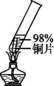
在探究金属与酸的反应时,发现铜片与20%的硫酸溶液不反应。有同学提出疑问“在一定条件下铜与硫酸能否发生反应”,并进行了系列实验。 【查阅资料】SO2能让红色的品红溶液褪色,能被NaOH溶液吸收。 【进行实验】(夹持仪器略) 实验1:初步实验(所用溶液均为硫酸溶液)
经检验实验1-1中产生的气体是氢气。 【解释与结论】 (1)实验1-1中,能证明铜发生反应的现象是 。 (2)实验1中,欲得出“升高温度可使铜与硫酸反应”需对比的实验是 (填实验序号)。
|
|||||||||||||||||||
| 14. | 详细信息 | ||||||||||||||||||||
|
酱油在使用及储藏过程中颜色会变深,逐渐降低品质。实验小组通过实验研究温度、氧气、光照3个因素对酱油颜色的影响。 【查阅资料】①通过色差仪检测L*值可监控酱油颜色变化,酱油颜色越深,L*值越小。②保鲜瓶具有的特点是挤出盛放的物质后,空气不会进入。 【实验准备】 将等量样品(同品牌、同批次、初始L*值为43.82的酱油)分装到500 mL的不同容器中,密封。 【进行实验】 实验1:将装有样品的多个透明玻璃瓶置于不同温度的恒温箱中。每15天,分别取出未开封样品,用色差仪检测L*值,结果如下。
【解释与结论】 (1)实验1得出的结论是 。
|
|||||||||||||||||||||
| 15. | 详细信息 | ||||||||||||||||||||||||||||||||||||||||
|
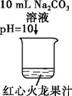
日常生活中,人们利用碳酸钠溶液具有碱性,清洗餐具上的油污,碱性越强,去油污的效果越好,化学小组同学决定对影响碳酸钠溶液碱性的因素展开探究。回答有关问题。 (1)用不同温度的水,分别配制2%、6%、10%的碳酸钠溶液,测量溶液的pH如下表:
②要得出碳酸钠溶液的溶质质量分数变化与pH变化关系的结论,可选择的一组实验是 (填实验序号),结论是 。
|
|||||||||||||||||||||||||||||||||||||||||
| 16. | 详细信息 | ||||||||||||||||||||
|
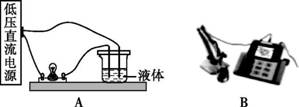
某兴趣小组同学进行溶液的导电性实验研究。 【查阅资料】 (1)溶液的导电性是指溶液传导电流的能力。溶液导电是因为溶液中存在大量自由移动的离子。 (2)利用图 A所示的装置试验溶液的导电性,灯泡越亮,表示溶液的导电性越强。 (3)溶液的导电性也可以用电导率仪(如图B)测定出的电导率数值大小进行衡量。电导率数值越大,溶液的导电性越强。
【提出问题1】溶液是否都能导电? 【进行实验1】25 ℃时,用图A装置进行如下三个实验。
【解释与结论】(2)通过实验1-2和实验1-3的对比,说明 对溶液的导电性有影响。
|
|||||||||||||||||||||
| 17. | 详细信息 | ||||||||||||||||||
|
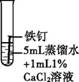
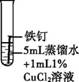
某兴趣小组发现铁钉生锈需要几天的时间,询问老师如何加快铁钉生锈的速率。老师说氯化物可能加快铁钉生锈的速率。 【提出问题】氯化物对铁钉生锈有怎样的影响? 【查阅资料】Ⅰ.NaCl、CaCl2、CuCl2等由氯离子与金属离子构成的盐属于氯化物。 Ⅱ.铜能与氧气反应,生成黑色的CuO。 Ⅲ.CuO能与稀硫酸发生反应:CuO+H2SO4 【进行实验、分析解释、获得结论】 实验1:探究氯化物对铁钉生锈速度的影响。
(1)对比实验①②③可以得到的结论是 。
|
|||||||||||||||||||
| 18. | 详细信息 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
某小组对“自制小火箭”的发射动力进行了如下探究。 【查阅资料】 ①火箭升空主要利用反冲原理:大量高温气体由火箭下方的喷气口向下喷出,使火箭获得向上的反作用力。当反作用力大于火箭受到的重力及空气阻力之和时,火箭飞离地面。 ②醋酸化学性质与盐酸相似。 探究一:火箭发射的化学动力
图T5-5 同学们利用如图T5-5所示装置,选择不同的化学反应,在常温下进行火箭模拟发射实验,相关数据如下。
【解释与结论】 (2)探究一中,分析实验组1和实验组2的实验数据可知,火箭发射的化学动力与 因素有关。
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 19. | 详细信息 | ||||||||||||||
|
某小组同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行探究。 【提出问题】①三种溶液的酸碱性? ②它们与酸反应时溶液的pH如何变化? 【查阅资料】
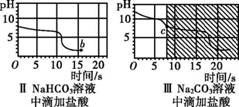
【实验2】向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图Ⅰ所示。
【实验3】向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图Ⅱ、图Ⅲ所示。将图Ⅱ与图Ⅲ的阴影部分进行叠加,发现两者基本重合。 【解释与结论】 (2)实验2证明了氢氧化钠能与盐酸发生反应,其理由是 , 实验结束,向反应后的溶液中滴加紫甘蓝汁液,观察到的现象是 。 (3)实验3中,b点的溶质为 ,c点后发生反应的化学方程式为 。 (4)依据实验3获取的信息,鉴别Na2CO3和NaHCO3固体的实验方案为 。
|
|||||||||||||||
| 20. | 详细信息 | ||||||||||||||
|
日常生活中,人们利用碳酸钠溶液具有碱性,清洗餐具上的油污,碱性越强,去油污的效果越好,化学小组同学决定对影响碳酸钠溶液碱性的因素展开探究。 (2)测得10%的碳酸钠溶液从20 ℃升温至70 ℃的pH如下表:
①由上表可知,温度对碳酸钠溶液的pH影响是 。
|
|||||||||||||||
| 21. | 详细信息 | ||||||||||||||||||||||||||||||||||||||||||||||||||
|
菠菜含有多种丰富的营养素。但菠菜也是一种草酸含量比较高的蔬菜,草酸会影响人体健康。同学们对菠菜进行不同处理,寻找去除菠菜中草酸的合理烹调方法,对如何食用菠菜提出合理化建议。 【查阅资料】①豆腐中含有钙盐,能与菠菜中可溶性草酸(H2C2O4)发生反应生成不被人体吸收的沉淀物草酸钙(CaC2O4)。 ②草酸钙是人体结石的主要成分。 【进行实验】实验1:用四种方法烹调,可溶性草酸去除率如下:
实验2:取1 L水煮开,加入豆腐和菠菜同煮,可溶性草酸去除率如下:
【解释与结论】 (3)对比实验ABC,可得出的结论是 。 (4)其他条件相同时,豆腐用量对菠菜中可溶性草酸去除率的影响不大,需要对比的实验是 (填实验编号)。
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
| 22. | 详细信息 | ||||||||||||||||||
|
食品工业中碘化钾(KI)可用作营养增补剂。碘化钾是白色固体,在空气中久置会“泛黄”变质。某实验小组对碘化钾变质后的成分及变质的条件进行探究。 Ⅲ.依据初步结论,深入探究变质的条件 实验3:分别取相同浓度的KI溶液进行实验,在空气中放置相同时间,现象如下表。
【解释与结论】 (5)实验3中,观察到③~⑤溶液颜色依次加深,推测其原因是 。
|
|||||||||||||||||||
| 23. | 详细信息 | ||||||
|
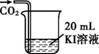
小明同学在“化学氧自救器”的说明书中看到“人呼出的CO2与自救器药罐中的生氧剂(超氧化钾KO2)接触能产生O2”,对自救器内发生的化学反应原理产生了探究兴趣。 【查阅资料】KO2能分别与CO2、H2O反应生成O2和一种化合物;未查到KO2能否与HCl反应的资料。 【提出问题】CO2与KO2反应生成的化合物是什么? 【作出猜想】是一种碳酸盐。 【进行实验】
你是否同意他的结论,请说明理由: 。
|
|||||||
| 24. | 详细信息 |
|
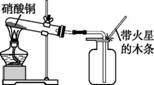
硝酸铜为蓝色固体,溶于水可得蓝色溶液。小明同学用如图所示装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃。
通过查阅资料并进行实验验证,可知Cu(NO3)2受热分解生成了CuO 、NO2和O2(2Cu(NO3)2 。
|
|
| 25. | 详细信息 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
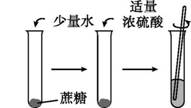
所示“黑面包”实验中,蔗糖(C12H22O11)变黑,体积膨胀,变成疏松的炭,放出有刺激性气味的气体。
【提出问题】改变糖的种类、浓硫酸的体积、水的滴数和温度是否会影响实验效果呢? 【进行实验】分别取5 g糖粉进行实验,根据前2 min 的现象对实验效果进行评分,记录如下: 表1 实验记录
【处理数据】分析表1,计算效果得分均值,结果如下: 表2 效果得分均值
依据均值推断最佳实验方案,均值越高,效果越好。 【解释与结论】 (1)蔗糖变成黑色的炭,发生了 (填“物理”或“化学”)变化。 (2)推测放出的气体含SO2,从元素守恒角度说明理由: 。 (3)实验6中,a为 mL。 (4)根据表2推断,“黑面包”实验最好选择5 g冰糖、5 mL浓硫酸、 滴水和50 ℃。 【反思与评价】 (5)表2中,22 ℃对应的均值为51.0,计算该值所依据的3个数据分别是 。 (6)综合分析,使实验3的效果得分高于实验4的因素有 。
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 26. | 详细信息 | |||||||||||||||||||||||||||||||||||
|
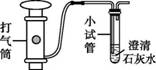
实验课上,同学们利用澄清石灰水检验空气中的二氧化碳,实验中发现各组石灰水浑浊程度存在较大差异,于是设计实验探究影响石灰水浑浊程度的因素。 【进行实验】装置如图所示。
实验1:取饱和澄清石灰水进行实验。
实验2:利用向饱和石灰水中添加蒸馏水来调节石灰水浓度进行实验(溶液浓度变化引起的溶液密度变化忽略不计)。
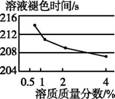
【解释与结论】 (1)小试管中发生反应的化学方程式为 。 (2)实验1的目的为 。 (3)实验2中a、b、c三处数据,设计合理的是 。 A.0.5 0.5 0.5 B.0.5 1.0 1.5 C.1.0 1.5 2.0 D.1.0 2.0 3.0 (4)实验2的结论是 。 【反思与评价】 (5)通过对比实验1-1和2-1,可得出影响石灰水浑浊程度的另一因素是 , 理由是 。
|
||||||||||||||||||||||||||||||||||||
| 27. | 详细信息 | ||||||||||||||||||
|
镁条在空气中久置表面会变黑。某小组同学设计并进行实验,探究镁条变黑的条件。
【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。 【猜想与假设】常温下,镁条变黑可能与O2、CO2、水蒸气有关。 【进行实验】通过控制与镁条接触的物质,利用图所示装置(镁条长度为3 cm,试管容积为20 mL),分别进行下列5个实验,并持续观察20天。
【解释与结论】 (1)实验1和2中,NaOH浓溶液的作用是 (用化学方程式表示)。 (2)实验1的目的是 。 (3)实验3中,试管内的气体主要含有CO2、 。 (4)得出“镁条变黑一定与CO2有关”的结论,依据的两个实验是 (填序号)。 (5)由上述实验可推知,镁条变黑的条件是 。 【反思与评价】 (6)在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是 。 (7)欲进一步证明镁条表面的黑色物质中含有碳酸盐,所需要的试剂是 。
|
|||||||||||||||||||
| 28. | 详细信息 | |||||||||||||||
|
实验小组以鸡蛋壳(主要成分CaCO3,在水中能溶解出微量的Ca2+,其他成分对实验影响忽略不计)为牙齿的替代物,模拟含氟牙膏保护牙齿的化学原理。 【查阅资料】①含氟牙膏保护牙齿的原因:含氟牙膏中的NaF能与牙齿表面溶解的微量Ca2+反应,生成更难溶于酸的物质。②常温下,酚酞溶液遇pH<8.2的碱性溶液不变色。 【进行实验】实验小组用2种不同的方法进行实验。
实验一:如图Ⅰ连接仪器,进行实验。
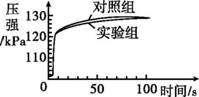
实验二:如图Ⅱ连接仪器,锥形瓶和注射器中的物质均与实验一相同。进行实验,测量压强随时间的变化如图所示。
【解释与结论】 (1)装入药品前,检查装置a的气密性:用弹簧夹夹住右侧胶皮管, ,说明装置气密性良好。 (2)实验一中: ①鸡蛋壳中主要成分与盐酸反应的化学方程式为 。 ②m处应填写的是 。 (3)实验二能证明含氟牙膏对鸡蛋壳有保护作用,其理由是 。 由此推断出实验一中,t1 (填“>”“<”或“=”)t2。 【反思与评价】 (4)根据本实验模拟的含氟牙膏保护牙齿的化学原理,推测下列摩擦剂一定不能用于制作含氟牙膏的是 (填序号)。 A.CaCO3 B.SiO2(二氧化硅) C.Al(OH)3
|
||||||||||||||||
| 29. | 详细信息 | ||||||||||||||||||||||||||||
|
某实验小组同学对铁粉和氧化铜的混合物与足量的硫酸混合后,体系中各反应的先后顺序进行研究。 【查阅资料】CuO+H2SO4 【进行实验】 实验1:将铁粉和氧化铜的混合物与60 mL 10%稀硫酸混合,实验记录如下。
实验2:将1.12 g铁粉和1.6 g氧化铜的混合物与30 mL不同浓度的硫酸混合,实验记录如下。
【解释与结论】 (1)浅绿色溶液中一定含有的溶质是H2SO4、 。 (2)实验中出现红色固体反应的化学方程式为 ;实验中出现气泡反应的化学方程式为 。 (3)依据实验1推测,在稀硫酸浓度为10%,且硫酸足量的条件下,铁粉、氧化铜与稀硫酸反应的先后顺序为 。 (4)对比分析实验1-2与1-3,解释实验1-2没有产生气泡的原因 。 (5)根据实验2判断,下列说法不正确的是 (填序号)。 A.硫酸浓度为20%,CuO先于Fe与硫酸反应 B.硫酸浓度为40%,Fe将先于CuO与硫酸反应 C.硫酸浓度为50%,Fe与CuSO4反应的同时也与硫酸反应
|
|||||||||||||||||||||||||||||
| 30. | 详细信息 | |||||||||||||||||||||||||||
|
化学小组同学在查阅“氢氧化钠使酚酞变红的原因”时,看到了以下资料: ①实验室所用酚酞溶液pH<8。酚酞的分子结构受pH影响,酚酞溶液的颜色受其分子结构影响,具体情况如下表所示。
②醌式结构的酚酞能与H2O2溶液发生反应,生成无色物质,且该物质在溶液中的颜色不受pH影响。 ③NaOH溶液浓度越大,溶液pH越高。 该小组同学对上述资料产生了兴趣,决定对酚酞溶液颜色的变化开展探究。 【进行实验】
【解释与结论】 (1)实验1-1中,可以观察到的实验现象是 。 (2)实验1-2中,溶液红色褪去的原因是 (用化学方程式表示)。 (3)实验1-3的目的是验证pH>13时,红色酚酞溶液会变成无色,则“向另一支试管中加入 ”。 (4)由实验2-1可以得到结论:H2O2能使变红的酚酞褪色, 。 (5)实验2-2的目的是 。
|
||||||||||||||||||||||||||||
| 31. | 详细信息 | ||||||||||||||||||||||||||||||||||||||||||
|
碳酸钠和碳酸氢钠是生活中常见的盐,通过实验验证、探究它们的化学性质。 【查阅资料】 ①Na2CO3+CaCl2 ②2NaHCO3 ③Ca(HCO3)2易溶于水。 ④CaCl2溶液分别与Na2CO3、NaHCO3溶液等体积混合的现象(表中的百分数为溶液中溶质的质量分数):
【进行实验】
【解释与结论】 (1)实验1中,NaHCO3与盐酸反应的化学方程式为 。 (2)实验2中,试剂a为 。 (3)实验3中,NaHCO3与CaCl2反应的化学方程式为:2NaHCO3+CaCl2 【反思与评价】 (1)实验2中,加热NaHCO3后,试管Ⅰ中残留固体成分可能为 (写出所有可能)。 (2)资料④中,NaHCO3溶液与CaCl2溶液混合的现象中,有些只观察到浑浊、未观察到气泡,原因可能是 。 (3)用两种不同的方法鉴别Na2CO3和NaHCO3固体,实验方案分别为: ① 。 ② 。
|
|||||||||||||||||||||||||||||||||||||||||||