2019广东高一上学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
朱自清先生在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里…月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影…”月光穿过薄雾所形成的美景仙境,其本质原因是 A. 夜里的月色本身就很美 B. 颗粒直径约为1nm﹣100nm的小水滴分散在空气中 C. 光线是一种胶体 D. 雾是一种胶体,能产生丁达尔现象
|
|
| 2. | 详细信息 |
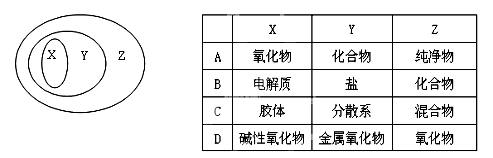
|
用如图表示的一些物质或概念间的从属关系中不正确的是
A. A B. B C. C D. D
|
|
| 3. | 详细信息 |
|
欲选用①AgNO3溶液,②HNO3溶液,③Ba(NO3)2溶液三种试剂,检验某待测液中是否含有Cl-、CO32-、SO42-三种离子。要求:只能取一次待测液;每加入一种试剂就要能检出一种离子。则加入试剂的先后顺序为 A. ①②③ B. ②①③ C. ②③① D. ①③②
|
|
| 4. | 详细信息 |
|
NA 为阿伏加德罗常数的值,下列说法正确的是 A. 标准状况下,2.24L CCl4中含有的分子总数为0.1NA B. 78 g Na2O2中含有的阴离子数为NA C. 金属钠与水反应,生成22.4L氢气时,转移的电子数为2NA D. 将含有1mol溶质的FeCl3溶液加入沸水中制取Fe(OH)3胶体,其含Fe(OH)3胶粒数为NA
|
|
| 5. | 详细信息 |
|
.为了实现下列各变化,需加入还原剂的是 A. KClO3→O2 B. CO2→CO C. Fe→FeCl3 D. NH4+→NH3
|
|
| 6. | 详细信息 |
|
下列离子方程式正确的是 A. 钠和冷水反应:Na + 2H2O===Na++2OH−+H2↑ B. NaOH溶液中通入少量CO2反应:OH-+CO2===HCO3- C. 铁粉加入稀硫酸:2Fe +6H+ =2Fe3+ +3H2↑ D. NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O
|
|
| 7. | 详细信息 |
|
在某无色透明的强酸性溶液中,能大量共存的离子组是 A. K+、Na+、Cu2+、SO42- B. Mg2+、Ba2+、Cl-、OH- C. Na+、Al3+、Cl-、NO3- D. K+、 AlO2-、 Cl-、Ba2+
|
|
| 8. | 详细信息 |
|
用1L 0.1mol·L-1NaOH溶液吸收0.07molCO2,所得溶液中n(Na2CO3)和n(NaHCO3)之比约为 A. 3︰4 B. 3︰1 C. 2︰3 D. 3︰2
|
|
| 9. | 详细信息 |
|
下列关于碳酸钠和碳酸氢钠的比较中,不正确的是 A. 二者在水中的溶解度不同,碳酸氢钠的溶解度小于碳酸钠 B. 二者热稳定性不同,碳酸钠的热稳定性大于碳酸氢钠 C. 二者都能与盐酸反应放出二氧化碳气体,二者等质量与足量盐酸反应时生成CO2量一样多 D. 二者在一定条件下可以相互转化
|
|
| 10. | 详细信息 |
|
关于反应CaH2+2H2O==Ca(OH)2+2H2↑,下列说法正确的是 A. H2O既不是氧化剂又不是还原剂 B. CaH2中H元素被还原 C. 此反应中氧化产物与还原产物的原子个数比为1:1 D. Ca(OH)2是氧化产物
|
|
| 11. | 详细信息 |
|
在酸性条件下,可发生如下反应:ClO3— + 2M3++ 4H2O = M2O7n— + Cl— + 8H+,M2O7n— 中M的化合价是 A. +4 B. +5 C. +6 D. +7
|
|
| 12. | 详细信息 | |||||||||||||||
|
下列实验现象描述正确的是
A. A B. B C. C D. D
|
||||||||||||||||
| 13. | 详细信息 |
|
下列关于钠与水反应的叙述,不正确的是 ①将一小粒钠投入滴有紫色石蕊溶液的水中,反应后溶液变红 ②将一小粒钠投入稀盐酸中,钠先与水反应,后与HCl反应 ③将一小粒钠投入水中,钠沉入水底 ④将两小粒质量相等的金属钠,一粒直接投入水中,另一粒用铝箔包住,在铝箔上刺些小孔,然后投入水中,则二者放出氢气的质量相等 A. ①②③ B. ②③ C. ②③④ D. ①②③④
|
|
| 14. | 详细信息 |
|
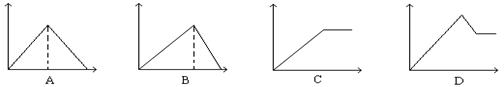
向MgSO4和Al2(SO4)3的混合溶液中, 逐滴加入NaOH溶液。下列图象中, 能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量)
A. A B. B C. C D. D
|
|
| 15. | 详细信息 |
|
(I)按要求回答下列问题: (1)在一定的温度和压强下,2 体积 X Y 2 (g)跟 3 体积Z2(g)化合生成 2 体积气态化合物,则该气态化合物的化学式是 _________(用X、Y、Z表示) (2)用KMnO4氧化盐酸,其反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,该反应中,氧化剂是________。当有1mol KMnO4和一定量盐酸恰好完全反应,反应后溶液的体积为2L ,则所得溶液中Cl—的物质的量浓度为_______,被氧化的HCl的物质的量为________。 (II)现有下列物质:①H2O、②空气、③Mg、④CaCO3、⑤H3PO4、⑥CuSO4﹒5H2O、⑦浓硝酸、⑧无水酒精、⑨硫酸、⑩盐酸。 其中,属于电解质的是____________(填序号,下同);属于非电解质的是____________;属于强电解质的是____________;能导电的是____________。
|
|
| 16. | 详细信息 |
|
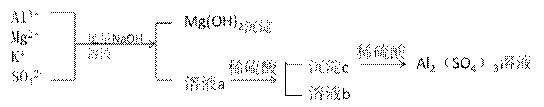
某校化学兴趣小组用如图所示过程除去硫酸铝中含有的Mg2+、K+杂质离子并尽可能减少硫酸铝的损失。
请回答下列问题: (1)混合物中加入足量氢氧化钠溶液时,反应的离子方程式是________________、________________________________。 (2)能否用氨水代替氢氧化钠溶液____________,其原因是____________________________。 (3)溶液a中存在的离子有________________________,在溶液a中加入稀硫酸时需控制硫酸的量,其原因是__________________________________________,改进方法是__________________________________________________________。
|
|
| 17. | 详细信息 |
|
实验室配制 1mol/L 的 NaOH 溶液240mL, (1)实验操作中用天平称量________g NaOH 固体; (2)容量瓶在使用前的操作是________________________ (3)若实验时遇到下列情况,所配溶液的浓度偏大的是_________。 ①称量氢氧化钠固体的时间过长。 ②容量瓶用蒸馏水洗涤后残留有少量的水。 ③溶液未冷却即转入容量瓶。 ④在转移氢氧化钠溶液后未洗涤烧杯。 ⑤定容时俯视刻度线。 ⑥摇匀后,发现溶液的液面低于刻度线,又加水至刻度线。 (4)取配制的 1mol/L 的 NaOH 溶液10 mL,再稀释成 100 m L,再从中取出 10 mL,这 10 mL 溶液的物质的量浓度为________。 (5)取配制的1mol/L 的 NaOH 溶液10 mL,加入足量的氧化铝充分反应(溶液体积保持不变),得到的溶液的浓度为_____________,发生反应的离子方程式为___________________。
|
|
| 18. | 详细信息 |
|
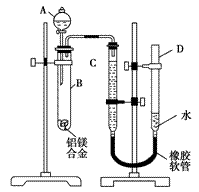
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
(1)A中试剂为________。 (2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是____________________。 (3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂。上述操作的顺序是________(填序号);记录C的液面位置时,除平视外,还应________。 (4)B中发生反应的化学方程式为__________________________。 (5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为________。 (6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________(填“偏大”“偏小”或“不受影响”)。
|
|