2017еҗүжһ—й«ҳдёҖдёӢеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
з»ҝиүІеҢ–еӯҰзҡ„зӣ®ж ҮжҳҜ(В В В В ) A. еҮҸе°‘еҜ№зҺҜеўғзҡ„жұЎжҹ“В В В B. з ”з©¶еҸҳжҚўеҹәжң¬еҺҹж–ҷе’Ңиө·е§ӢеҢ–еҗҲзү© C. и®ҫи®ЎеҜ№дәәзұ»еҒҘеә·е’ҢзҺҜеўғжӣҙе®үе…Ёзҡ„еҢ–еҗҲзү©В В В D. йҳІжӮЈдәҺжңӘ然пјҢжңҖз»Ҳжқңз»қеҢ–еӯҰжұЎжҹ“жәҗ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—жңүе…іеҢ–еӯҰз”ЁиҜӯиЎЁзӨәжӯЈзЎ®зҡ„жҳҜ(В В В В ) A. иҙЁеӯҗж•°дёә53гҖҒдёӯеӯҗж•°дёә78зҡ„зўҳеҺҹеӯҗпјҡ B. S2-зҡ„з»“жһ„зӨәж„ҸеӣҫпјҡВ C. N2зҡ„з»“жһ„ејҸпјҡ D. NH4Iзҡ„з”өеӯҗејҸпјҡВ
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жҖ§иҙЁдёӯпјҢеҸҜд»ҘиҜҒжҳҺжҹҗеҢ–еҗҲзү©еҶ…дёҖе®ҡеӯҳеңЁзҰ»еӯҗй”®зҡ„жҳҜ(В В В В ) A. еҸҜжә¶дәҺж°ҙВ В В B. жңүиҫғй«ҳзҡ„зҶ”зӮ№ C. ж°ҙжә¶ж¶ІиғҪеҜјз”өВ В В D. зҶ”иһҚзҠ¶жҖҒиғҪеҜјз”ө
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—йҮ‘еұһдёӯпјҢйҖҡеёёйҮҮз”ЁзғӯиҝҳеҺҹжі•еҶ¶зӮјзҡ„жҳҜ(В В В В ) A. NaВ В В B. AlВ В В C. FeВ В В D. Ag
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
В в‘ жәҙеҢ–й’ жә¶ж¶Іе’Ңжәҙж°ҙзҡ„ж··еҗҲжә¶ж¶ІгҖҒв‘Ўд№ҷй…ёд№ҷй…Ҝе’Ңд№ҷй…ёй’ жә¶ж¶ІпјҢеҲҶзҰ»е®ғ们зҡ„жӯЈзЎ®ж–№жі•дҫқж¬ЎжҳҜ(В В В В ) A. еҲҶж¶ІгҖҒи’ёйҰҸВ В В B. и’ёйҰҸгҖҒеҲҶж¶І C. еҲҶж¶ІгҖҒиҗғеҸ–В В В D. иҗғеҸ–гҖҒеҲҶж¶І
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
В еҲҶеӯҗејҸдёәC4H10O并иғҪдёҺйҮ‘еұһй’ еҸҚеә”ж”ҫеҮәж°ўж°”зҡ„жңүжңәзү©жңү(дёҚеҗ«з«ӢдҪ“ејӮжһ„) (В В В В ) A. 3з§ҚВ В В B. 4з§ҚВ В В C. 5з§ҚВ В В D. 6з§Қ
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҚеә”дёӯеүҚиҖ…еұһдәҺеҸ–д»ЈеҸҚеә”пјҢеҗҺиҖ…еұһдәҺеҠ жҲҗеҸҚеә”зҡ„жҳҜ(В В В В ) A. з”Ізғ·дёҺж°Ҝж°”ж··е’ҢеҗҺе…үз…§еҸҚеә”пјӣд№ҷзғҜдҪҝй…ёжҖ§й«ҳй”°й…ёй’ҫжә¶ж¶Ізҡ„иӨӘиүІ B. д№ҷзғҜдёҺжәҙзҡ„еӣӣж°ҜеҢ–зўіжә¶ж¶ІеҸҚеә”пјӣиӢҜдёҺж°ўж°”еңЁдёҖе®ҡжқЎд»¶дёӢеҸҚеә”з”ҹжҲҗзҺҜе·ұзғ· C. иӢҜдёҺжө“зЎқй…ёе’Ңжө“зЎ«й…ёзҡ„ж··еҗҲж¶ІеҠ зғӯеҸҚеә”пјӣд№ҷзғҜдёҺж°ҙеңЁдёҖе®ҡжқЎд»¶дёӢз”ҹжҲҗд№ҷйҶҮзҡ„еҸҚеә” D. еңЁиӢҜдёӯж»ҙе…Ҙжәҙж°ҙпјҢжәҙж°ҙеұӮеҸҳж— иүІпјӣд№ҷзғҜз”ҹжҲҗиҒҡд№ҷзғҜзҡ„еҸҚеә”
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—е…ідәҺжңүжңәеҢ–еҗҲзү©зҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В В В ) A. д№ҷй…ёе’Ңд№ҷй…ёд№ҷй…ҜеҸҜз”ЁNa2CO3жә¶ж¶ІеҠ д»ҘеҢәеҲ« B. жҲҠзғ·жңүдёӨз§ҚеҗҢеҲҶејӮжһ„дҪ“ C. д№ҷзғҜгҖҒиҒҡд№ҷзғҜе’ҢиӢҜеҲҶеӯҗеқҮеҗ«жңүзўізўіеҸҢй”® D. зі–зұ»гҖҒжІ№и„Ӯе’ҢиӣӢзҷҪиҙЁеқҮеҸҜеҸ‘з”ҹж°ҙи§ЈеҸҚеә”
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„дёӯеҢ–еҗҲзү©зҡ„жҖ§иҙЁжҜ”иҫғпјҢдёҚжӯЈзЎ®зҡ„жҳҜ(В В В В ) A. й…ёжҖ§пјҡHClO4>HBrO4>HIO4В В В B. зўұжҖ§пјҡNaOH>Mg(OH)2>Al(OH)3 C. зЁіе®ҡжҖ§пјҡPH3>H2S>HClВ В В D. йқһйҮ‘еұһжҖ§пјҡF>O>S
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„зі–иғҪеҸ‘з”ҹж°ҙи§ЈпјҢдё”еұһдәҺиҝҳеҺҹжҖ§зі–зҡ„жҳҜ(В В В В ) A. и‘Ўиҗ„зі–В В В B. йәҰиҠҪзі–В В В C. ж·ҖзІүВ В В D. зәӨз»ҙзҙ
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В В В ) A. еҫҖи”—зі–ж¶ІдёӯеҠ е…ҘзЁҖзЎ«й…ёпјҢж°ҙжөҙеҠ зғӯе……еҲҶеҸҚеә”еҗҺеҠ е…Ҙж–°еҲ¶ж°ўж°§еҢ–й“ңжӮ¬жөҠж¶ІпјҢеҠ зғӯпјҢеҸҜи§Ғжңүз –зәўиүІВ жІүж·Җз”ҹжҲҗ B. иҰҒиҗғеҸ–жәҙж°ҙдёӯзҡ„жәҙеҚ•иҙЁпјҢеҸҜд»ҘйҖүз”ЁиӢҜгҖҒCCl4жҲ–й…’зІҫеҒҡиҗғеҸ–еүӮ C. еҶ°йҶӢй…ёгҖҒж·ҖзІүгҖҒзәӨз»ҙзҙ йғҪжҳҜзәҜеҮҖзү© D. з”ЁиҜ•з®ЎеҸ–еҮәе°‘йҮҸж·ҖзІүж°ҙи§Јж¶ІпјҢеҠ е…Ҙзўҳж°ҙпјҢиӢҘдёҚжҳҫи“қиүІпјҢиҜҙжҳҺж·ҖзІүж°ҙи§Је®Ңе…Ё
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
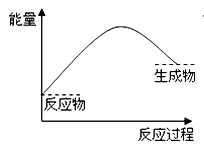
В дёӢеҲ—еҸҚеә”еҸҜд»ҘиЎЁзӨәеҰӮдёӢеӣҫзҡ„иғҪйҮҸеҸҳеҢ–зҡ„жҳҜ(В В В В )
A. Alе’ҢFe2O3зҡ„й“қзғӯеҸҚеә”В В В B. Ba(OH)2.8H2OдёҺNH4Clзҡ„еҸҚеә” C. NaOHжә¶ж¶ІдёҺCH3COOHжә¶ж¶ІеҸҚеә”В В В D. з”Ізғ·еңЁO2дёӯзҡ„зҮғзғ§еҸҚеә”
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
жҠҠaгҖҒbгҖҒcгҖҒdеӣӣеқ—йҮ‘еұһжөёжіЎеңЁзЁҖзЎ«й…ёдёӯпјҢз”ЁеҜјзәҝдёӨдёӨиҝһжҺҘеҸҜд»Ҙз»„жҲҗеҺҹз”өжұ пјҢиӢҘaгҖҒbзӣёиҝһж—¶пјҢaдёәиҙҹжһҒпјӣcгҖҒdзӣёиҝһж—¶пјҢcдёәиҙҹжһҒпјӣaгҖҒcзӣёиҝһж—¶пјҢcдёәжӯЈжһҒпјӣbгҖҒdзӣёиҝһж—¶пјҢbдёәжӯЈжһҒгҖӮеҲҷиҝҷеӣӣз§ҚйҮ‘еұһзҡ„жҙ»еҠЁйЎәеәҸжңүеӨ§еҲ°е°Ҹдёә(В В В В ) A. C.
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
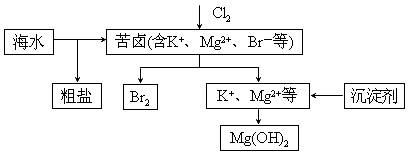
В жө·ж°ҙејҖеҸ‘еҲ©з”Ёзҡ„йғЁеҲҶиҝҮзЁӢеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ(В В В В )
A. еҗ‘иӢҰеҚӨдёӯйҖҡе…ҘCl2жҳҜдёәдәҶжҸҗеҸ–жәҙ B. зІ—зӣҗеҸҜйҮҮз”ЁйҷӨжқӮе’ҢйҮҚз»“жҷ¶зӯүиҝҮзЁӢжҸҗзәҜ C. е·Ҙдёҡз”ҹдә§еёёйҖүз”ЁNaOHдҪңдёәжІүж·ҖеүӮ D. еҜҢйӣҶжәҙдёҖиҲ¬е…Ҳз”Ёз©әж°”е’Ңж°ҙи’ёж°”еҗ№еҮәеҚ•иҙЁжәҙпјҢеҶҚз”ЁSO2е°Ҷе…¶иҝҳеҺҹеҗёж”¶
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
дёӢеҲ—е®һйӘҢж“ҚдҪңгҖҒе®һйӘҢзҺ°иұЎеҸҠжүҖеҫ—еҮәзҡ„з»“и®әеқҮжӯЈзЎ®зҡ„жҳҜ(В В В В )
A. AВ В В B. BВ В В C. CВ В В D. D
|
|||||||||||||||||||||
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
В е·ІзҹҘз”ІиӢҜзҡ„дёҖж°Ҝд»Јзү©жңү4з§ҚпјҢеҲҷз”ІиӢҜдёҺж°ўж°”е®Ңе…ЁеҠ жҲҗеҗҺзҡ„дә§зү©зҡ„дёҖж°Ҝд»Јзү©еә”иҜҘе…·жңүзҡ„з§Қзұ»жҳҜ(В В В В ) A. 2з§ҚВ В В B. 4з§ҚВ В В C. 5з§ҚВ В В D. 7з§Қ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗжңүжңәзү©зҡ„з»“жһ„з®ҖејҸдёә A. иғҪдҪҝй…ёжҖ§KMnO4жә¶ж¶ІиӨӘиүІВ В В B. иғҪеҸ‘з”ҹй…ҜеҢ–еҸҚеә” C. иғҪи·ҹNaOHжә¶ж¶ІеҸҚеә”В В В D. иғҪеҸ‘з”ҹж°ҙи§ЈеҸҚеә”
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
В 1molжҹҗзғғеңЁж°§ж°”дёӯе……еҲҶзҮғзғ§пјҢйңҖиҰҒж¶ҲиҖ—ж°§ж°”179.2L(ж ҮеҮҶзҠ¶еҶө)гҖӮе®ғеңЁе…үз…§зҡ„жқЎд»¶дёӢдёҺж°Ҝж°”еҸҚеә”иғҪз”ҹжҲҗдёүз§ҚдёҚеҗҢзҡ„дёҖж°ҜеҸ–д»Јзү©гҖӮиҜҘзғғзҡ„з»“жһ„з®ҖејҸжҳҜ(В В В В ) A. C.
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—е…ідәҺе…ғзҙ е‘ЁжңҹиЎЁе’Ңе…ғзҙ е‘ЁжңҹеҫӢзҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В В В ) A. з”ұдәҺFе…ғзҙ зҡ„жңҖдҪҺеҢ–еҗҲд»·дёә-1д»·пјҢж•…Fе…ғзҙ зҡ„жңҖй«ҳеҢ–еҗҲд»·дёә+7д»· B. 第дәҢе‘Ёжңҹе…ғзҙ д»ҺLiеҲ°FпјҢйқһйҮ‘еұһжҖ§йҖҗжёҗеҮҸејұ C. з”ұдәҺKжҜ”Naе®№жҳ“еӨұеҺ»з”өеӯҗпјҢжүҖд»ҘKжҜ”Naзҡ„иҝҳеҺҹжҖ§ејә D. з”ұдәҺH2Sзҡ„зӣёеҜ№еҲҶеӯҗиҙЁйҮҸеӨ§дәҺH2Oзҡ„зӣёеҜ№еҲҶеӯҗиҙЁйҮҸпјҢжүҖд»ҘжІёзӮ№еүҚиҖ…еӨ§дәҺеҗҺиҖ…
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
зҹӯе‘Ёжңҹе…ғзҙ RгҖҒTгҖҒQгҖҒWеңЁе…ғзҙ е‘ЁжңҹиЎЁдёӯзҡ„зӣёеҜ№дҪҚзҪ®еҰӮеӣҫжүҖзӨәпјҢе…¶дёӯTжүҖеӨ„зҡ„е‘ЁжңҹеәҸж•°дёҺж—ҸеәҸж•°зӣёзӯүгҖӮдёӢеҲ—еҲӨж–ӯдёҚжӯЈзЎ®зҡ„жҳҜ(В В В В )
A. жңҖз®ҖеҚ•ж°”жҖҒж°ўеҢ–зү©зҡ„зғӯзЁіе®ҡжҖ§пјҡR > Q B. жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©зҡ„й…ёжҖ§пјҡQ < W C. еҺҹеӯҗеҚҠеҫ„пјҡT > Q > R D. еҗ«Tзҡ„зӣҗжә¶ж¶ІдёҖе®ҡжҳҫй…ёжҖ§
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
В XгҖҒTгҖҒZдёүз§Қзҹӯе‘Ёжңҹе…ғзҙ пјҢеҺҹеӯҗеҚҠеҫ„зҡ„еӨ§е°Ҹе…ізі»дёәпјҡr(Y) > r(X) > r(Z)пјҢеҺҹеӯҗеәҸж•°д№Ӣе’Ңдёә16гҖӮXгҖҒTгҖҒZз§Қе…ғзҙ зҡ„еёёи§ҒеҚ•иҙЁеңЁйҖӮеҪ“жқЎд»¶дёӢеҸҜеҸ‘з”ҹдёӢеӣҫжүҖзӨәеҸҳеҢ–пјҢе…¶дёӯBе’ҢCеқҮдёә10 з”өеӯҗеҲҶеӯҗгҖӮдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ(В В В В )
A. Xе…ғзҙ дҪҚдәҺв…ҘAж—ҸВ В В B. AдёҚиғҪжә¶дәҺBдёӯ C. Aе’ҢCдёҚеҸҜиғҪеҸ‘з”ҹж°§еҢ–иҝҳеҺҹеҸҚеә”В В В D. Bзҡ„жІёзӮ№й«ҳдәҺCзҡ„жІёзӮ№
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘпјҡв‘ еҗ‘KMnO4еӣәдҪ“дёӯж»ҙеҠ жө“зӣҗй…ёпјҢдә§з”ҹй»„з»ҝиүІж°”дҪ“пјӣв‘Ўеҗ‘FeCl2жә¶ж¶ІдёӯйҖҡе…Ҙе°‘йҮҸе®һйӘҢв‘ дә§з”ҹзҡ„ж°”дҪ“пјҢжә¶ж¶ІеҸҳй»„иүІпјӣв‘ўеҸ–е®һйӘҢв‘Ўз”ҹжҲҗзҡ„жә¶ж¶Іж»ҙеңЁж·ҖзІү-KIиҜ•зәёдёҠпјҢиҜ•зәёеҸҳи“қиүІгҖӮдёӢеҲ—еҲӨж–ӯжӯЈзЎ®зҡ„жҳҜ(В В В В ) A. дёҠиҝ°е®һйӘҢиҜҒжҳҺж°§еҢ–жҖ§пјҡMnO4- > Cl2 > Fe3+ > I2 B. дёҠиҝ°е®һйӘҢдёӯпјҢе…ұжңүдёӨдёӘж°§еҢ–иҝҳеҺҹеҸҚеә” C. е®һйӘҢв‘ з”ҹжҲҗзҡ„ж°”дҪ“дёҚиғҪдҪҝж№ҝж¶Ұзҡ„ж·ҖзІү-KIиҜ•зәёеҸҳи“қ D. е®һйӘҢв‘ЎиҜҒжҳҺFe2+ж—ўжңүж°§еҢ–жҖ§еҸҲжңүиҝҳеҺҹжҖ§
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүдёҖ瓶еҸҜиғҪйғЁеҲҶиў«ж°§еҢ–зҡ„Na2SO3жә¶ж¶ІпјҢжҹҗеҗҢеӯҰиҝӣиЎҢеҰӮдёӢе®һйӘҢпјҡеҸ–е°‘йҮҸжӯӨжә¶ж¶ІпјҢж»ҙе…ҘBa(NO3)2жә¶ж¶ІпјҢдә§з”ҹзҷҪиүІжІүж·ҖпјҢеҶҚеҠ е…Ҙи¶ійҮҸзЁҖзЎқй…ёпјҢе……еҲҶжҢҜиҚЎеҗҺпјҢд»ҚжңүзҷҪиүІжІүж·ҖгҖӮдёӢиҝ°жңүе…іжӯӨе®һйӘҢзҡ„з»“и®әжӯЈзЎ®зҡ„жҳҜ(В В В В ) A. Na2SO3е·ІйғЁеҲҶиў«з©әж°”дёӯзҡ„ж°§ж°”ж°§еҢ– B. еҠ е…ҘBa(NO3)2жә¶ж¶ІеҗҺпјҢз”ҹжҲҗзҡ„жІүж·ҖдёӯдёҖе®ҡеҗ«жңүBaSO4 C. еҠ зЎқй…ёеҗҺзҡ„зҷҪиүІжІүж·ҖдёҚдёҖе®ҡжҳҜBaSO4 D. жӯӨе®һйӘҢдёҚиғҪзЎ®е®ҡNa2SO3жҳҜеҗҰйғЁеҲҶиў«ж°§еҢ–
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
В й•ҒгҖҒй“қгҖҒй“ҒеҗҲйҮ‘жҠ•е…Ҙ300 mL HNO3жә¶ж¶ІдёӯпјҢйҮ‘еұһжҒ°еҘҪжә¶и§ЈпјҢеҲҶеҲ«иҪ¬еҢ–жҲҗMg2+гҖҒAl3+е’ҢFe3+пјӣиҝҳеҺҹдә§зү©дёәNOпјҢеңЁж ҮеҮҶзҠ¶еҶөдёӢдҪ“з§Ҝдёә6.72LгҖӮеңЁеҸҚеә”еҗҺзҡ„жә¶ж¶ІдёӯеҠ е…Ҙ300 mLжҹҗжө“еәҰзҡ„NaOHжә¶ж¶ІпјҢйҮ‘еұһйҳізҰ»еӯҗжҒ°еҘҪе…ЁйғЁжІүж·ҖпјҢе№ІзҮҘеҗҺжөӢеҫ—иҙЁйҮҸдёә27.2gгҖӮдёӢеҲ—жңүе…іжҺЁж–ӯжӯЈзЎ®зҡ„жҳҜ(В В В В ) A. еҸӮеҠ еҸҚеә”зҡ„HNO3зҡ„зү©иҙЁзҡ„йҮҸдёә0.9 mol B. еҸӮеҠ еҸҚеә”зҡ„йҮ‘еұһзҡ„иҙЁйҮҸдёә11.9 g C. HNO3зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә3 molВ·L-1 D. NaOHзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә6 molВ·L-1
|
|
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
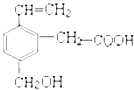
В жҹҗжңүжңәзү©зҡ„з»“жһ„з®ҖејҸеҰӮеӣҫпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В В В )
A. иҜҘжңүжңәзү©зҡ„еҲҶеӯҗејҸдёәC11H15O3 B. иҜҘжңүжңәзү©дёҚиғҪеҸ‘з”ҹеҸ–д»ЈеҸҚеә” C. 1molиҜҘзү©иҙЁдёҺи¶ійҮҸзҡ„й’ еҸҚеә”еҸҜд»Ҙз”ҹжҲҗ1molж°ўж°” D. 1molиҜҘжңүжңәзү©еҸҜд»ҘдёҺ1molзўій…ёй’ еҸ‘з”ҹеҸҚеә”
|
|
| 26. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗжңүжңәзү©AеҢ–еӯҰејҸдёәCxHyOzпјҢ15g Aе®Ңе…ЁзҮғзғ§еҸҜз”ҹжҲҗ22g CO2е’Ң9g H2OгҖӮиҜ•жұӮпјҡ пјҲ1пјүиҜҘжңүжңәзү©зҡ„жңҖз®ҖејҸ______________пјӣ пјҲ2пјүиӢҘAзҡ„зӣёеҜ№еҲҶеӯҗиҙЁйҮҸдёә60пјҢдё”Aе’ҢNa2CO3жә¶ж¶ІеҸҚеә”жңүж°”дҪ“ж”ҫеҮәпјҢAе’ҢйҶҮиғҪеҸ‘з”ҹй…ҜеҢ–еҸҚеә”пјҢеҲҷAзҡ„з»“жһ„з®ҖејҸдёә_________________пјӣ пјҲ3пјүиӢҘAзҡ„зӣёеҜ№еҲҶеӯҗиҙЁйҮҸдёә60пјҢдё”AжҳҜжҳ“жҢҘеҸ‘жңүж°ҙжһңйҰҷе‘ізҡ„ж¶ІдҪ“пјҢиғҪеҸ‘з”ҹж°ҙи§ЈеҸҚеә”пјҢеҲҷе…¶з»“жһ„з®ҖејҸдёә_______________________гҖӮ
|
|
| 27. | иҜҰз»ҶдҝЎжҒҜ |
|
В дә”з§Қзҹӯе‘Ёжңҹе…ғзҙ AгҖҒBгҖҒCгҖҒDгҖҒEзҡ„еҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§пјҢAе’ҢCеҗҢж—ҸпјҢBе’ҢD еҗҢж—ҸпјҢCзҰ»еӯҗе’ҢBзҰ»еӯҗе…·жңүзӣёеҗҢзҡ„з”өеӯҗеұӮз»“жһ„гҖӮAе’ҢBгҖҒDгҖҒEеқҮиғҪеҪўжҲҗе…ұд»·еһӢеҢ–еҗҲзү©гҖӮAе’ҢBеҪўжҲҗзҡ„еҢ–еҗҲзү©еңЁж°ҙдёӯе‘ҲзўұжҖ§пјҢCе’ҢEеҪўжҲҗзҡ„еҢ–еҗҲзү©еңЁж°ҙдёӯе‘ҲдёӯжҖ§гҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүдә”з§Қе…ғзҙ дёӯпјҢеҺҹеӯҗеҚҠеҫ„жңҖеӨ§зҡ„жҳҜ_________пјҢйқһйҮ‘еұһжҖ§жңҖејәзҡ„жҳҜ_________ (еЎ«е…ғзҙ з¬ҰеҸ·)пјӣ пјҲ2пјүз”ұAе’ҢBгҖҒDгҖҒEжүҖеҪўжҲҗзҡ„е…ұд»·еһӢеҢ–еҗҲзү©дёӯпјҢзғӯзЁіе®ҡжҖ§жңҖе·®зҡ„жҳҜ___________ (з”ЁеҢ–еӯҰејҸиЎЁзӨә)пјӣ пјҲ3пјүAе’ҢEеҪўжҲҗзҡ„еҢ–еҗҲзү©дёҺAе’ҢBеҪўжҲҗзҡ„еҢ–еҗҲзү©еҸҚеә”пјҢдә§зү©зҡ„еҢ–еӯҰејҸдёә______________пјҢе…¶дёӯеӯҳеңЁзҡ„еҢ–еӯҰй”®зұ»еһӢдёә_______________пјӣ пјҲ4пјүжҜ”иҫғDгҖҒEжңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©зҡ„й…ёжҖ§еӨ§е°Ҹе…ізі»_____________________пјӣ (з”ЁеҢ–еӯҰејҸиЎЁзӨә) пјҲ5пјүеҚ•иҙЁEдёҺж°ҙеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә_________________________пјӣ пјҲ6пјүCжңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©дёҺEжңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ____________гҖӮ
|
|
| 28. | иҜҰз»ҶдҝЎжҒҜ |
|
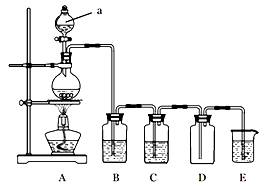
дёӢеӣҫжҳҜе®һйӘҢе®ӨдёӯеҲ¶еӨҮж°”дҪ“жҲ–йӘҢиҜҒж°”дҪ“жҖ§иҙЁзҡ„иЈ…зҪ®еӣҫгҖӮ
пјҲ1пјүд»ӘеҷЁaзҡ„еҗҚз§°жҳҜ__________гҖӮ пјҲ2пјүеҲ©з”ЁдёҠеӣҫиЈ…зҪ®еҲ¶еӨҮзәҜеҮҖгҖҒе№ІзҮҘзҡ„ж°Ҝж°”гҖӮ в‘ еңҶеә•зғ§з“¶еҶ…еҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә______________________________пјӣ в‘ЎиЈ…зҪ®Bдёӯжә¶ж¶Ідёә________________пјҢзғ§жқҜEдёӯжә¶ж¶Ізҡ„дҪңз”Ёдёә____________гҖӮ пјҲ3пјүиӢҘеҲ©з”ЁеӣҫиЈ…зҪ®иҜҒжҳҺSO2е…·жңүжјӮзҷҪжҖ§гҖҒиҝҳеҺҹжҖ§еҸҠз”ҹжҲҗж°”дҪ“дёӯеҗ«жңүCO2гҖӮеңҶеә•зғ§з“¶еҶ…еҠ е…ҘзўіпјҢaдёӯеҠ е…Ҙжө“зЎ«й…ёпјҢBгҖҒDдёӯеқҮдёәе°‘йҮҸе“Ғзәўжә¶ж¶ІпјҢCдёӯдёәи¶ійҮҸй…ёжҖ§й«ҳй”°й…ёй’ҫжә¶ж¶ІпјҢEдёӯдёәжҫ„жё…зҹізҒ°ж°ҙгҖӮ в‘ иҜҒжҳҺSO2е…·жңүжјӮзҷҪжҖ§зҡ„иЈ…зҪ®жҳҜ________пјҢзҺ°иұЎжҳҜ____________________пјӣ в‘ЎиҜҒжҳҺSO2е…·жңүиҝҳеҺҹжҖ§зҡ„зҺ°иұЎжҳҜ______________________пјӣ в‘ўDиЈ…зҪ®зҡ„дҪңз”ЁжҳҜ________________пјӣ в‘ЈиҜҒжҳҺз”ҹжҲҗж°”дҪ“дёӯеҗ«жңүCO2зҡ„зҺ°иұЎжҳҜ____________________________________гҖӮ
|
|
| 29. | иҜҰз»ҶдҝЎжҒҜ |
|
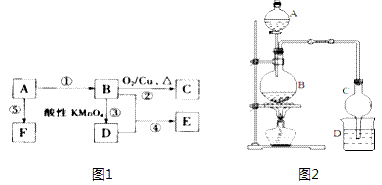
е·ұзҹҘAгҖҒBгҖҒCгҖҒDгҖҒEгҖҒFжҳҜдёӯеӯҰеҢ–еӯҰдёӯеёёи§Ғзҡ„е…ӯз§Қжңүжңәзү©пјҢе®ғ们иҪ¬еҢ–е…ізі»еҰӮеӣҫ1жүҖзӨә(йғЁеҲҶзү©иҙЁе·ІзңҒз•Ҙ)гҖӮе…¶дёӯAжҳҜдёҖз§Қз”ҹзү©з”ҹй•ҝи°ғиҠӮеүӮпјҢEе…·жңүж°ҙжһңйҰҷе‘іпјҢFжҳҜдёҖз§ҚеҸҜеҲ¶жҲҗеӨҡз§ҚеҢ…иЈ…жқҗж–ҷзҡ„й«ҳеҲҶеӯҗеҢ–еҗҲзү©гҖӮ
пјҲ1пјүAзҡ„з”өеӯҗејҸдёә_________пјҢCзҡ„з»“жһ„з®ҖејҸдёә____________пјҢDеҲҶеӯҗдёӯе®ҳиғҪеӣўзҡ„еҗҚз§°____________гҖӮ пјҲ2пјүеҶҷеҮәеӣҫlжңүжңәеҸҚеә”зұ»еһӢв‘ ______________пјӣ в‘Ў______________гҖӮ пјҲ3пјүеҶҷеҮәеӣҫ1иҪ¬еҢ–иҝҮзЁӢдёӯзҡ„еҢ–еӯҰеҸҚеә”ж–№зЁӢејҸв‘Ў_____________________пјӣв‘Ө__________________гҖӮ пјҲ4пјүжҹҗиҜҫеӨ–е°Ҹз»„и®ҫи®Ўзҡ„е®һйӘҢе®ӨеҲ¶еҸ–д№ҷй…ёд№ҷй…Ҝзҡ„иЈ…зҪ®еҰӮеӣҫ2жүҖзӨәпјҢAдёӯж”ҫжңүжө“зЎ«й…ёпјҢBдёӯж”ҫжңүд№ҷйҶҮгҖҒйҶӢй…ёпјҢDдёӯж”ҫжңүйҘұе’Ңзўій…ёй’ жә¶ж¶ІгҖӮиҜ·еӣһзӯ”пјҡ в‘ жө“зЎ«й…ёзҡ„дҪңз”ЁжҳҜ_____________________пјӣ в‘Ў иӢҘз”ЁеҗҢдҪҚзҙ 18Oж Үи®°д№ҷйҶҮдёӯзҡ„ж°§еҺҹеӯҗпјҢеҲҷCH3CH218OHдёҺд№ҷй…ёз”ҹжҲҗд№ҷй…ёд№ҷй…Ҝзҡ„еҢ–еӯҰж–№зЁӢејҸдёә_____________________________________________________________пјӣ в‘ў зҗғеҪўе№ІзҮҘз®ЎCзҡ„дҪңз”ЁжҳҜ_____________________________пјӣ в‘Ј еҸҚеә”з»“жқҹеҗҺDдёӯзҡ„зҺ°иұЎ_____________________________гҖӮ
|
|
- еҢ—дә¬еёӮй«ҳдёүеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·жЁЎжӢҹиҖғиҜ•з»ғд№
- еҗ•жўҒеёӮй«ҳдёүеҢ–еӯҰ2018е№ҙдёҠеҚҠе№ҙй«ҳиҖғжЁЎжӢҹиҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§Јжһҗ
- е®ҒеӨҸзҹіеҳҙеұұеёӮй«ҳдёүеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•ж‘ёеә•иҖғиҜ•йўҳеҗҢжӯҘи®ӯз»ғ
- й«ҳдёҖеҢ–еӯҰдёҠеҶҢеҚ•е…ғжөӢиҜ•еҲ·йўҳи®ӯз»ғ
- еӣӣе·қзңҒд»ҒеҜҝеҺҝ铧ејәдёӯеӯҰ2021еұҠй«ҳдёү12жңҲжңҲиҖғзҗҶз»јеҢ–еӯҰйўҳе…Қиҙ№еңЁзәҝжЈҖжөӢ
- дёҠжө·еёӮй«ҳдёүеҢ–еӯҰдёҠеҶҢжңҹдёӯиҖғиҜ•йўҳеёҰзӯ”жЎҲе’Ңи§Јжһҗ
- е®үеҫҪзңҒе…ӯе®үеёӮиЈ•е®үеҢәж–°е®үдёӯеӯҰ2020-2021е№ҙй«ҳдәҢдёҠеҚҠжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ
- еӨ©жҙҘеёӮ2020е№ҙй«ҳдёүеҢ–еӯҰдёҠжңҹе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ

 В В В В B.
В В В В B.