2019河北高二上学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
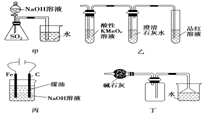
用下列各实验装置进行相应的实验,能达到实验目的的是( )
B.用图乙装置检验某混合气体是否由SO2和CO2混合而成 C.用图丙装置制备Fe(OH)2并能较长时间观察其颜色 D.用图丁装置干燥、收集氯化氢,并吸收多余的氯化氢
|
|
| 2. | 详细信息 |
|
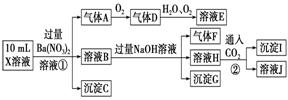
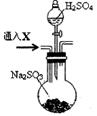
某强酸性溶液X中可能含有Fe2+、Al3+、NH 现取X溶液进行连续实验,实验过程及产物如图,下列说法正确的是( )
B.X溶液中肯定存在Fe2+、Al3+、NH C.溶液E和气体F不能发生化学反应 D.X溶液中不能确定的离子是Al3+和Cl-
|
|
| 3. | 详细信息 |
|
A. X使蔗糖变黑的现象主要体现了X的脱水性 B.若A为铁,则足量A与X在常温下即可完全反应 C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到有白色沉淀产生 D.工业上,B转化为D的反应条件为高温、高压、使用催化剂
|
|
| 4. | 详细信息 | |||
|
A、B、C、X均为中学化学常见的物质,一定条件下它们有如下转化关系(部分产物已略去),下 列说法错误的是( ) A.若X为Cl2,则C可能为FeCl3 B.若X为KOH溶液,则A可能为AlCl3溶液 C.若X为O2,则A可能为H2S D.若A、B、C均为焰色反应呈黄色的化合物,则X可能为CO2
|
||||
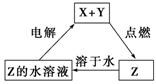
| 5. | 详细信息 | |||
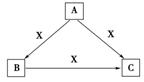
|
X、Y、Z是中学化学中三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关 系(未注明反应条件),下列说法不正确的是( ) A.若X为金属单质,Y为非金属固体单质,则Z为O2 B.若X、Y均为金属单质,则甲不可能为黑色固体 C.若X为金属单质,Y为非金属气体单质,则乙可能为黑色固体 D.若X、Y均为非金属固体单质,则Z可能为O2
|
||||
| 6. | 详细信息 | ||||||||||||||||||||||||||
|
利用下图所示装置进行下列实验,能得出相应实验结论的是( )
|
|||||||||||||||||||||||||||
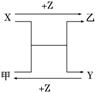
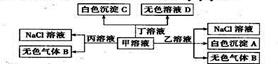
| 7. | 详细信息 |
|
A.X可能是金属铜 B.Y不可能是氢气 C.Z可能是氯化钠 D.Z可能是三氧化硫
|
|
| 8. | 详细信息 |
|
H+、Na+、Al3+、Ba2+、OH-、HCO3一、Cl-七种离子形成了甲、乙、 丙、丁四种化合物,它们之 间可以发生如下转化关系(产物H2O未标出),下列说法不正确的是 ( )
B.在甲中滴加丁可能发生反应: HCO3-+ Ba2+ + OH- C.溶液丙与I一、NO3一、SO42-可以大量共存 D.溶液甲中一定满足:c(H2CO3) + c(H+)=c(OH-) + c(CO32-)
|
|
| 9. | 详细信息 |
|
下列说法不正确的是( ) A.将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色 B.SO2通入Fe2(SO4)3溶液中,无明显现象 C.SO2通入已酸化的Ba(NO3)2溶液中,出现白色沉淀 D.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去
|
|
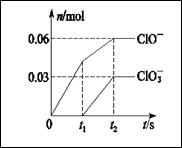
| 10. | 详细信息 |
|
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物 中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意 图如图所示。下列说法正确的是( ) A.苛性钾溶液中KOH的质量是4.94 g B.反应中转移电子的物质的量是0.09 mol C.氧化性ClO-<ClO3- D.ClO3-的生成是由于温度升高引起的
|
|
| 11. | 详细信息 |
|
下列说法中不正确的是( ) A. σ键比π键重叠程度大,形成的共价键强 B. 两个原子之间形成共价键时,最多有一个σ键 C. 气体单质中,一定有σ键,可能有π键 D. N2分子中有一个σ键,两个π键
|
|
| 12. | 详细信息 |
|
金属钾晶体为体心立方结构,则在单位晶胞中钾原子的个数是 A. 4 B. 3 C. 2 D. 1
|
|
| 13. | 详细信息 |
|
.AB,CD,EF均为1∶1型离子化合物,根据下列数据判断它们的熔沸点由高到低的顺序是( )
A. CD>AB>EF B. AB>EF>CD C. AB>CD>EF D. EF>AB>CD
|
|
| 14. | 详细信息 |
|
下列对sp3、sp2、sp杂化轨道的夹角的比较,得出结论正确的是( ) A. sp杂化轨道的夹角最大 B. sp2杂化轨道的夹角最大 C. sp3杂化轨道的夹角最大 D. sp3、sp2、sp杂化轨道的夹角相等
|
|
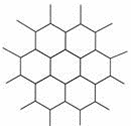
| 15. | 详细信息 |
|
. 石墨晶体是层状结构,在每一层内,每一个碳原子都跟其他3个碳原子相结合,下图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是( ) A. 10个 B. 18个 C. 24个 D. 14个
|
|
| 16. | 详细信息 | |||
|
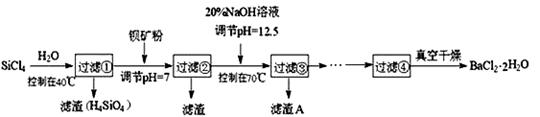
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,遇水能强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分 为BaCO3,且含有铁、镁等离子),制备BaCl2·2H2O,工艺流程如下:
已知: ① 常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4; ② BaCO3的相对分子质量是197;BaCl2·2H2O的相对分子质量是244。 回答下列问题: ⑴ SiCl4发生水解反应的化学方程式为______________________________________________ ⑵ 用H2还原SiCl4蒸气可制取纯度很高的硅,当反应中有1 mol电子转移时吸收59 kJ热量,则 该反应的热化学方程式为___________ ____________ ⑶ 加钡矿粉并调节pH=7的目的是①______________________,②______________________ ⑷ 过滤②后的滤液中Fe3+浓度为_______________(滤液温度25℃,Ksp[Fe(OH)3]=2.2×10-38)。 ⑸ 生成滤渣A的离子方程式 _______________________________________ ⑹ BaCl2滤液经 、 、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O
|
||||
| 17. | 详细信息 |
|
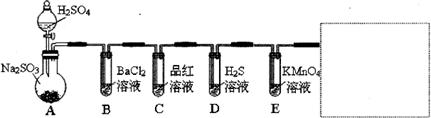
研究性学习小组用Na2SO3与硫酸溶液(硫酸与水体积比1∶1)制备SO2并进行性质探究实验。
⑴ D中的实验现象是 ,C、E中溶液都褪色,分别体现SO2 、 性质。 ⑵ 请在方框中画出收集SO2以及尾气处理装置(标相关试剂)。 ⑶ 研究小组发现B中有白色沉淀,为了清楚沉淀的物质,研究小组往B中加入过量稀盐酸,沉淀 不溶解,你认为留下的沉淀物是 ,形成该沉淀的反应方程式有:
为了进一步验证沉淀原因,研究小组另取BaC12溶液,加热煮沸,冷却及 时加入少量苯液封,然后再通SO2,结果发现沉淀量减少,但仍有轻微浑 浊。研究小组改进A装置(如右图),再进行实验,B中没有出现浑浊。 下列气体可作为X气体的是 A.CO2 B.NH3 C.O3 D.N2 E.NO2 ⑷ SO2为空气污染物,研究小组为测定某工厂区空气中SO2的含量,取10m3(标准状况)的空气, 缓慢通过足量溴水中,在所得溶液中加入过量的BaC12溶液,将产生的白色沉淀洗涤、干燥, 用电子称称其质量为0.233g,则: ① 检验洗涤已经干净的实验操作是 。 ② 试计算此空气中SO2的浓度(列出计算表达式并计算结果,结果单位用mg/m3表示)。
|
|
| 18. | 详细信息 | ||||||||
|
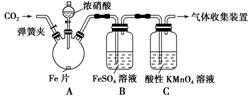
+4、+2、-3价氮的化合物。 Ⅱ.FeSO4 + NO Ⅲ.NO2和NO都能被酸性KMnO4溶液氧化吸收。 甲按照如图所示的实验装置进行实验: 实验操作和现象记录如表所示:
请回答下列问题: ① 加热前,向烧瓶中滴入浓硝酸没有明显现象的原因是 ② 检验是否生成-3价氮的化合物,应进行的实验操作是 ③ 甲取少量B中溶液,加热,实验现象是 请用化学平衡原理解释原因 甲依据该现象得出结论:铁与硝酸反应有NO生成。 ④ 乙认为甲得出A中有NO生成的证据不足。为获取充足的证据,乙仍采用该装置和操作进行 对照实验,乙作出的改变是 , 证明有NO生成的实验现象是
|
|||||||||