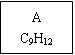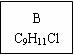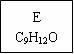2015黑龙江高三下学期人教版高中化学高考模拟
| 1. | 详细信息 |
|
下列说法正确的是( ) A.硫酸钠溶液和醋酸铅溶液均能使蛋白质变性 B.金属腐蚀的本质是金属原子失电子被氧化的过程 C.工业生产玻璃、水泥、陶瓷,均需要用石灰石为原料 D.人造纤维、合成纤维和光导纤维都是有机高分子化合物
|
|
| 2. | 详细信息 |
|
分子式为C10H14的二取代芳烃,其可能的结构有( ) A.3种 B.6种 C.9种 D.10种
|
|
| 3. | 详细信息 |
|
NA代表阿伏伽德罗常数。已知C2H4和C3H6的混合物的质量为ag,则该混合物( ) A.所含共用电子对数目为(a/7+1)NA B.所含碳氢键数目为aNA/7 C.燃烧时消耗的O2一定是33.6a/14L D.所含原子总数为aNA/14
|
|
| 4. | 详细信息 |
|
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( ) A.水既是氧化剂又是溶剂 B.放电时正极上有氢气生成 C.放电时OH-向正极移动 D.总反应为:2Li+2H2O === 2LiOH+H2↑
|
|
| 5. | 详细信息 |
|
下列说法不正确的是( ) A.Al箔插入稀HNO3中无现象因Al箔表面被HNO3氧化,形成致密的氧化膜 B.“硝基苯制备”实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触 C.“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,必须干燥或润洗后方可使用 D.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶
|
|
| 6. | 详细信息 |
|
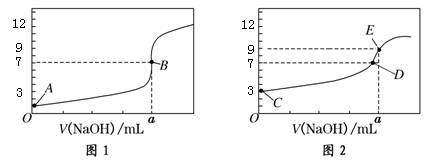
常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L HCl溶液和20.00 mL 0.1000 mol/L CH3COOH溶液,得到2条滴定曲线,如下图所示:
以下说法正确的是( ) A.图1是滴定CH3COOH 溶液的曲线 B.图2若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色 C.点D所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) D.如果C、E两点对应的pH分别为3、9,则水电离的氢离子浓度之比为1∶100
|
|
| 7. | 详细信息 |
|
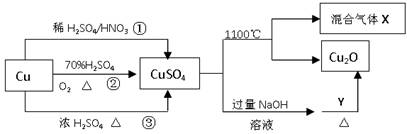
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )
A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2 B.相对于途径①、③,途径②更好地体现了绿色化学思想 C.1molCuSO4在1100℃所得混合气体X中O2为0.75mol D.Y可以是葡萄糖
|
|
| 8. | 详细信息 |
|
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。 请回答下列问题: (1)碘是 (填颜色)固体物质,实验室常用 方法来分离提纯含有少量杂质的固体碘。 (2)写出碘酸钾在酸性介质中与过氧化氢反应的离子方程式: (3)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。图中的序号3应为 离子交换膜(填“阳”或“阴”);电解时,阳极上发生反应的电极反应式为 。 (4)教材中利用KI与空气的反应来探究反应速率与温度的关系,现有1mol/L的KI溶液、0.1mol/L的H2SO4溶液、淀粉溶液,则实验时这几种试剂的加入顺序为: KI溶液、 、 ;反应的离子方程式为 。 (5)已知KI+I2 A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
|
|
| 9. | 详细信息 |
|
碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
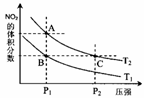
(2)298 K时,在2L的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变 化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。 ①298k时,该反应的平衡常数为________。 ②在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
b.B、C两点的气体的平均相对分子质量:B<C c.A、C两点气体的颜色:A深,C浅 d.由状态B到状态A,可以用加热的方法 ③若反应在398K进行,某时刻测得n(NO2)=0.6 mol n(N2O4)=1.2mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
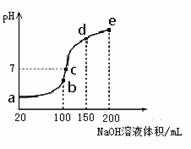
试分析图中a、b、c、d、e五个点, ①水的电离程度最大的是__________; ②其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值的是 ; ③在c点,溶液中各离子浓度由大到小的排列顺序是_______ 。
|
|
| 10. | 详细信息 |
|
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)
已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g。 实验流程: ①往装置A中加入2.7mL(2.3 g)甲苯和125 mL水,然后分批次加入8.5 g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热。 ②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品。 ③纯度测定:称取1.220g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示。
请回答: (1)装置A的名称 。若不用温度计,本实验控制反应温度的措施为 。 (2)白色粗产品中除了KCl外,其他可能的无机杂质为____ 。 (3)操作②中趁热过滤的目的是 , 操作I的名称 。 (4)步骤③中用到的定量仪器有分析天平, ,50mL酸式、碱式滴定管。 (5)样品中苯甲酸纯度为 。 (6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果将 (填“偏大”、“偏小”或“不变”)。
|
|
| 11. | 详细信息 |
|
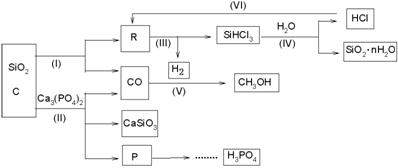
由Ca3(PO4)2 、SiO2 、焦炭等为原料生产硅胶(SiO2·nH2O)、磷、磷酸及CH3OH,下列工艺过程原料综合利用率高,废弃物少。
(1)上述反应中,属于置换反应的是 [选填:(Ⅰ)、(Ⅱ)、(Ⅲ)、(Ⅳ)、(Ⅴ)] (2)高温下进行的反应Ⅱ的化学方程式为: ; 固体废弃物CaSiO3可用于 。 (3)反应Ⅲ需在隔绝氧气和无水条件下进行,其原因是 。 (4)CH3OH可用作燃料电池的燃料,在强酸性介质中,负极的电极反应式为 。 (5)指出(VI)这一环节在工业生产上的意义 (6)写出由P→H3PO4 有关反应式 ① ②
|
|
| 12. | 详细信息 |
|
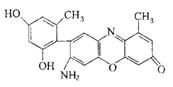
(1)金刚石和石墨是碳元素的两种常见单质,下列叙述中正确的有 a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化
c.晶体的熔点:金刚石<石墨 d.晶体中共价键的键角:金刚石>石墨 (2)某石蕊的分子结构如右图所示。 ①石蕊分子所含元素中,第一电离能由小到大的顺序是 ,基态原子2p轨道有两个成单电子的是 (填元素符号); 由其中两种元素形成的三角锥构型的一价阳离子是 (填化学式); ②该石蕊易溶解于水,分析可能的原因是 ; (3)铜及其合金是人类最早使用的金属材料。 ①NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2 上述化学方程式中的5种物质所属的晶体类型有_______(填序号)。 a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体, ②NF3与NH3均为三角锥形,但前者键角小于后者,原因是
乙
|
|
| 13. | 详细信息 |
|
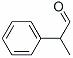
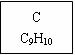
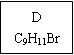
龙葵醛(
龙葵醛 (1)龙葵醛的分子式为 ,其中含氧官能团的名称是 ; A物质得到的1H-NMR谱中有 个吸收峰,B的结构简式可能为 。 (2)反应③的反应类型为 ,反应⑤的反应条件为 。 (3)反应⑥的化学方程式为 。 (4)龙葵醛具有多种同分异构体,其中某些物质有下列特征:a.其水溶液遇FeCl3溶液呈紫色;b.苯环上的一溴代物有两种;c.分子中没有甲基。写出符合上述条件的物质可能的结构简式(只写两种):
|
|