2017山东高二下学期鲁科版高中化学期末考试
| 1. | 详细信息 |
|
生活中的一些问题常涉及化学知识,下列叙述正确的是 A. 皂化反应就是乙酸乙酯等酯类物质在碱性条件下的水解 B. 纤维素可以在人体内水解为葡萄糖,而作人类的营养物质 C. 豆浆煮沸后蛋白质变成氨基酸 D. 食用油反复加热会产生稠环芳烃等有害物质
|
|
| 2. | 详细信息 |
|
在下列变化中需加入还原剂才能实现的是 A. KClO3→HCl B. Na2O2→O2 C. Fe Cl3→FeCl2 D. SO2→SO3
|
|
| 3. | 详细信息 |
|
下列有关仪器刻度位置的叙述正确的是 A. 容量瓶容积的刻度线刻在瓶颈上 B. 滴定管的“0”标线刻在管的下端 C. 托盘天平游码刻度尺的“0”标线刻在尺的右边 D. 量筒的最下端刻“0”标线
|
|
| 4. | 详细信息 |
|
在下列反应中属于氧化还原反应且水做还原剂的是 A. Cl2+H2O=HCl+HClO B. 2H2O+2F2=4HF+O2 C. ICl+H2O=HCl+HIO D. 2Na+2H2O=2NaOH+H2↑
|
|
| 5. | 详细信息 |
|
不能用带橡胶塞的玻璃试剂瓶存放的药品是( ) ①浓硝酸 ②稀氢氧化钠溶液 ③液溴 ④纯碱溶液 ⑤氢氟酸 A. ①③⑤ B. ②④ C. ①③ D. ①②③④⑤
|
|
| 6. | 详细信息 |
|
下列叙述正确的是( ) A. 有单质参加或单质生成的化学反应一定是氧化还原反应 B. 金属阳离子只有氧化性 C. SO2具有较强还原性,浓H2SO4有很强的氧化性,不能用浓H2SO4干燥SO2 D. 1molFe溶于过量硝酸,转移3mol电子
|
|
| 7. | 详细信息 |
|
下列有关实验操作的叙述错误的是 A. 过滤操作中,漏斗的尖端应接触烧杯内壁 B. 从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁 C. 滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 D. 向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁
|
|
| 8. | 详细信息 | |||||||||||||||||||||||||
|
提纯下列物质所选试剂及对应分离方法均可行的是
A. A B. B C. C D. D
|
||||||||||||||||||||||||||
| 9. | 详细信息 |
|
下列关于物质或离子检验的叙述正确的是 A. 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ B. 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 C. 向某溶液中加入BaCl2溶液,出现白色沉淀,再加稀硝酸溶液,若沉淀不溶解,则该溶液中肯定有SO42- D. 向某溶液中加入Na2CO3溶液,出现白色沉淀,再加稀盐酸,若沉淀消失,则该溶液中肯定有Ca2+
|
|
| 10. | 详细信息 |
|
下列做法合理的是 A. 金属钠着火时用泡沫灭火器灭火 B. 洗净的锥形瓶和容量瓶可以放进烘箱中烘干 C. 酸碱滴定实验时用待测液润洗锥形瓶可以减少实验误差 D. 做蒸馏实验时,在沸腾前发现忘记加沸石,应立即停止加热,待冷却后补加
|
|
| 11. | 详细信息 |
|
下列有关操作或说法正确的是 A. 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 B. 滴定时,眼睛应始终注视滴定管内液面的变化 C. 直接在酒精灯上加热烧瓶、坩埚、烧杯等仪器 D. NaCl溶液加热蒸发结晶时大量晶体析出停止加热
|
|
| 12. | 详细信息 |
|
2016年10月17日,“神舟11号”在酒泉发射升空,并取得圆满成功。“神舟11号”的运载火箭所用燃料是偏二甲肼(C2H8N2)和四氧化二氮(N2O4)。在火箭升空过程中,燃料发生反应: A. 该燃料绿色环保,在燃烧过程中不会造成任何环境污染 B. 该反应中N2O4是氧化剂,偏二甲肼是还原剂 C. N2既是氧化产物又是还原产物,CO2既不是氧化产物也不是还原产物 D. 每有0.6 mol N2生成,转移电子数目为2.4NA
|
|
| 13. | 详细信息 |
|
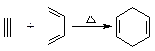
已知: A. 2-甲基-l,3-丁二烯和1-丁炔 B. 1,3-戊二烯和2-丁炔 C. 2,3-二甲基-1,3-戊二烯和乙炔 D. 2,3-二甲基-l,3-丁二烯和丙炔
|
|
| 14. | 详细信息 |
|
工业上利用铝粉除去含氮废水中的NO3-,当控制溶液PH=10.7左右时,所得产物中氮气和氨气的物质的量之比为4:1,则除去含0.1mol NO3-,的废水消耗铝粉的质量至少为 A. 3.53g B. 4.80g C. 5.04g D. 8.64g
|
|
| 15. | 详细信息 |
|
某稀溶液中含有4mol KNO3和2.5molH2SO4,向其中加入1.5mol Fe,充分反应(已知NO3-被还原为NO).下列说法正确的是( ) A. 反应后生成NO的体积为28 L B. 所得溶液中c(NO3-)=2.75 mol.L-1 C. 所得溶液中c(Fe2+):c(Fe3+ )=1:1 D. 所得溶液中的溶质只有FeSO4
|
|
| 16. | 详细信息 |
|
运用下列装置和操作能达到实验目的和要求的是
A. 用①分离氯化铵和单质碘 B. 用②除去淀粉溶液中的氯化钠 C. 用③加热胆矾(CuSO4·5H2O)制取无水硫酸铜 D. 用④装置收集NO或CO
|
|
| 17. | 详细信息 | |||||||||||||||||||||||||
|
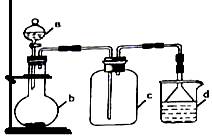
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略了净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
A. A B. B C. C D. D
|
||||||||||||||||||||||||||
| 18. | 详细信息 |
|
为检验产品中Mn2+,取产品少许溶于4mol/L硫酸中,加入少量NaBiO3粉末,搅拌,将过量的试剂离心沉降后,溶液呈紫红色(反应中铋被还原为Bi3+),则反应中氧化剂与还原剂的物质的量之比为 A. 5:2 B. 2:5 C. 5:1 D. 1:5
|
|
| 19. | 详细信息 |
|
(1)请按要求写出下列反应的化学方程式或离子方程式: ①物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,写出该反应的化学方程式________。 ②ClO2常用于水的净化,工业上可用Cl2氧化Na ClO2溶液制取ClO2.写出该反应的离子方程式:__________。 ③Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为________。 ④NaBH4是一种重要的储氢载体,能与水反应达到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为_________。 (2)四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O62-+2H2O。请回答下列问题。 ①水热法制备Fe3O4纳米颗粒的反应中,还原剂是_________。反应的化学方程式中x=_________。 ②每生成1 mol Fe3O4,反应转移的电子为________mol,被Fe2+还原的O2的物质的量为________mol。
|
|
| 20. | 详细信息 |
|
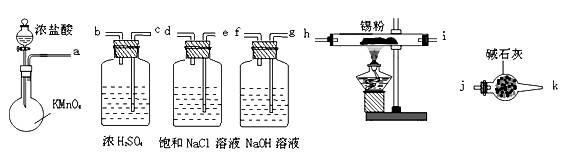
已知在金属活动顺序表中锡(Sn)位于Fe与Cu之间. (1)为了测定金属锡样品的纯度(假定杂质不参加反应),实验步骤如下:将a g金属锡样品溶于盐酸中.向上述溶液中加入过量的FeCl3溶液(发生的反应为:Sn2++2Fe3+=Sn4++2Fe2+).用b mol/L的K2Cr2O7溶液滴定生成的Fe2+,共用去K2Cr2O7 溶液m mL. 请回答: ①用盐酸溶解金属时发生反应的离子方程式________。 ②已知酸性环境下,Cr2O72- 可被Fe2+还原为Cr3+,则Ⅲ中反应的离子方程式是:_________________。 ③样品中锡的质量分数是________________(Sn的摩尔质量为M g/mol,用含a、b、m、M的代数式表示)。 (2)兴趣小组同学用如图所示装置在实验室中制取无水SnCl4.已知SnCl4易水解
①按气流方向各接口的正确连接顺序是a_____________________gf。 ②干燥管的作用是______________________________________。 ③NaOH溶液中发生反应的离子方程式___________。
|
|
| 21. | 详细信息 |
|
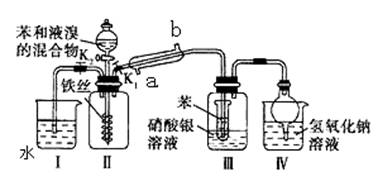
兴趣小组同学用如下图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。请回答下列问题
(1)冷凝管所起的作用为冷凝回流蒸汽。冷凝水从________(填a或b)口进入。 (2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。III中小试管内苯的作用是________________________。 (3)能说明苯与液溴发生了取代反应的现象是___________________。 (4)反应结束后要使装置I中的水倒吸入装置Ⅱ中.这样操作的目的是________________________________________________________________________________,简述这一操作方法____________________________________________________________________________________________________。 (5)整套实验装置中能防止倒吸的装置有________(填装置序号)。 (6)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。 ①用蒸馏水洗涤,振荡,分液;②用5%的NaOH溶液洗涤,振荡,分液; ③用蒸馏水洗涤,振荡,分液;④加入无水CaCl2粉末干燥; ⑤__________________________________(填操作名称)。
|
|
| 22. | 详细信息 |
|
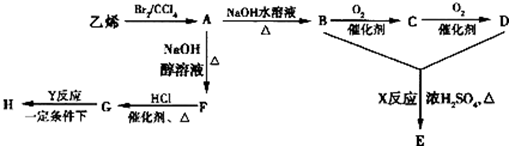
由乙烯和其他无机原料合成环状酯E和高分子化合物H的示意图如图所示:
请回答下列问题: (1)写出A的结构简式:______________,C的名称是___________。 (2)一定条件下三分子F发生聚合,所的产物的结构简式为__________。 (3)写出以下反应的化学方程式: A→B:___________________________; G→H:___________________________。 (4)将环状酯E与NaOH水溶液共热,则发生反应的化学方程式为__________。
|
|
| 23. | 详细信息 |
|
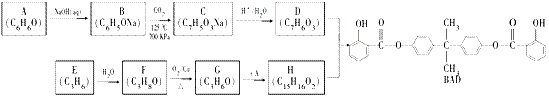
紫外线吸收剂(BAD)合成路线如下:
已知: ①G核磁共振氢谱显示所有氢原子化学状态相同 ②D、H能与FeCl3溶液发生显色反应 ③E能使溴水褪色 试回答下列各题: (1)A的名称________。 (2)E→F的反应类型________;BAD的所含的含氧官能团________(写名称)。 (3)F→G的化学方程式________________________________________________。 (4)C的结构简式为____________;H的结构简式为____________。 (5)D的同分异构体中含有苯环且能发生银镜反应的共有______种,其中核磁共振氢谱四种不同化学环境的氢,且峰面积比为2∶2∶1∶1的是____________(写结构简式)。
|
|