2016河南高三下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可以得到该物质固体的是 A.AlCl3 B.Na2SO3 C.KMnO4 D.MgSO4
|
|
| 2. | 详细信息 |
|
科学家已发现一种新型氢分子,其化学式为H3,在相同条件下,等质量的H3和H2相同的是 A.分子数 B.原子数 C.体积 D.物质的量
|
|
| 3. | 详细信息 |
|
元素的性质反映了元素的原子结构,并体现了其在元素周期表中的位置。下列说法正确的是 A.元素周期表中非金属元素都在短周期 B.N、P、As得电子能力减弱。最高价氧化物对应水化物均可表示为H3YO4 C.元素周期表中过渡元素只包括金属元素 D.A一1zX、AzX、A+1zX在元素周期表中的位置、原子核外电子排布相同,但性质不同
|
|
| 4. | 详细信息 |
|
下列表达式正确的是 A.CH3 COOH溶液中CH3 COOH的电离:CH3 COOH = H + + CH3 COO— B.用CuCl2溶液做导电实验,灯泡发光:CuCl2 C.NaHCO3溶液中HCO3一的水解:HCO3一+ H2 O D.将FeCl3溶液滴入Na2CO3溶液中:2Fe3+ + 3 CO32‾ + 3 H2 O = 2Fe(OH)3 ↓+ 3 CO2↑
|
|
| 5. | 详细信息 |
|
短周期元素T、Q、R、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等.它们的最高价氧化物的水化物依次为甲、乙、丙、丁.下列叙述不正确的是
A.R的氢化物可以既有极性键又有非极性键 B.常温下丁的浓溶液可用T单质所制的容器来盛装 C.丁的浓溶液与Q的单质加热发生反应,可生成体积比为1:2的两种气体 D.甲、乙、丙、丁受热均易分解
|
|
| 6. | 详细信息 |
|
Cl2、HCl的混合气体通入足量的氢氧化钠溶液,充分反应后分析产物溶液中除大量 OH− 试问原混合气体中Cl2与HCl体积比为( ) A.2:5 B.3:1
|
|
| 7. | 详细信息 |
|
将1molN2和3molH2进行合成氨试验后,测得反应后混合气体(N2、H2和NH3)的平均摩尔质量为10.2g·mol-1,则N2的转化率约为 A.18% B.20% C.25% D.33%
|
|
| 8. | 详细信息 |
|
下图是元素周期表的一部分,Y原子最外层电子数是次外层电子数的3倍,下列说法正确的是
A.简单氢化物稳定性:X>Z B.简单离子半径: Y<M C.最高价氧化物水化物的酸性:X<Z D.得电子能力:X>Y
|
|
| 9. | 详细信息 |
|
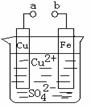
某小组为研究电化学原理,设计如右图装置。下列叙述正确的是( )
A、a和b用导线连接时,铁片上会有金属铜析出 B、a和b用导线连接时,铜片上发生的反应为:Cu2+—2e― = Cu C、无论a和b是否连接,铁片均会溶解 D、无论a和b是否连接,铁片上发生的反应都是:Fe —3e― =Fe3+
|
|
| 10. | 详细信息 |
|
有机物与生产、生活密切相关。下列说法不正确的是 A.天然气的主要成分是甲烷 B.棉花的主要成分是淀粉 C.酒精类饮料中含有乙醇 D.牛奶中含有蛋白质
|
|
| 11. | 详细信息 |
|
常温下取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为 A.0.01mol/L B.0.017mol/L C.0.05mol/L D.0.50mol/L
|
|
| 12. | 详细信息 |
|
10mL浓度为1mol·L-1的盐酸与过量的锌粉反应,若加入适量的下列固体,能减慢反应速率但又不影响氢气生成量的是 A.CH3COONa B.KNO3 C.CuSO4 D.Na2CO3
|
|
| 13. | 详细信息 |
|
下列应用特征现象推断不正确的是( ) A.遇FeCl3溶液显紫色或加入溴水产生白色沉淀,表示物质中可能含有酚羟基。 B.加入新制Cu(OH)2悬浊液并加热,有红色沉淀生成,或加入银氨溶液并水浴加热有银镜出现,说明该物质中含有—CHO C.加入金属钠,有H2产生,表示物质可能有—OH或—COOH D.加入NaHCO3溶液有气体放出或能使紫色石蕊试液变红,表示物质中含有—COOH
|
|
| 14. | 详细信息 |
|
下列说法不正确的是( ) A.粘有油脂的试管可以用热的纯碱溶液洗涤 B.石油的分馏、裂化、裂解都是化学变化 C.食醋中含有乙酸,乙酸可由乙醇氧化得到 D.煤可与水蒸气反应制成水煤气,水煤气的主要成分为CO和H2
|
|
| 15. | 详细信息 |
|
同温同压下,等质量的O2和CO2相比较,下列叙述正确的是 A.体积比为8:11 B.分子个数之比为11:12 C.物质的密度之比为11:8 D.原子个数之比为11:12
|
|
| 16. | 详细信息 |
|
现有以下几种物质请用其对应的序号填空:①氧化钙 ②稀硫酸 ③二氧化硫 ④熔融的BaSO4 ⑤铜 ⑥氢氧化钠 ⑦蔗糖 (1)上述物质属于电解质的是 ;(2)属于非电解质的是 ; (3)能导电的是 ;(4)任选一个电解质写出其电离方程式: .
|
|
| 17. | 详细信息 |
|
将三种气态烃以任意比例混合,与足量的氧气在密闭容器里完全燃烧,在温度不变的条件下(
|
|
| 18. | 详细信息 | ||||||||||||||||||
|
实验室常利用甲醛法测定某(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO = 4H+ +(CH2)6N4+6H2O,然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验: 步骤① 用电子天平准确称取样品1.5000 g。 步骤② 将样品溶解并冷却后,完全转移到250 mL容量瓶中,定容,充分摇匀。 步骤③ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛,摇匀、静置5min,加入2滴酚酞试液,用NaOH标准溶液滴定到终点。重复步骤③操作2次。 (1)根据步骤③填空: ①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数将 (填“偏高”、“偏低”或“无影响”)。 ②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积将 (填“偏大”、“偏小”或“无影响”)。 ③滴定时边滴边摇动锥形瓶,眼睛应观察 。 A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化 ④滴定达到终点时,酚酞指示剂由 色变为 色,半分钟内不退色。 ⑤滴定后俯视读数,测得样品中氮的质量分数将 (填“偏高”、“偏低”或“无影响”)。 (2)滴定结果如下表所示:
若NaOH标准溶液的浓度为0.1000 mol·L-1,则该样品中氮的质量分数为 。(保留两位小数)
|
|||||||||||||||||||
| 19. | 详细信息 |
|
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol/L的NaOH溶液滴定上述稀H2SO425mL,滴定终止时消耗NaOH溶液15mL. (1)该学生用标准0.14mol/L NaOH溶液滴定硫酸的实验操作如下: A.用酸式滴定管取稀H2SO4 25mL,注入锥形瓶中,加入指示剂. B.用待测定的溶液润洗酸式滴定管. C.用蒸馏水洗干净滴定管. D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下. E.检查滴定管是否漏水. F.另取锥形瓶,再重复操作一次. G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度. ①滴定操作的正确顺序是(用序号填写): . ②该滴定操作中应选用的指示剂是: . ③在G操作中如何确定终点? . (2)分析下列操作的结果:(填“偏小”、“偏大”或“恰好合适”) 碱式滴定管用蒸馏水润洗后,未用标准液润洗,导致滴定结果 . 碱式滴定管滴定前读数时仰视,结束时读数平视,导致滴定结果 . (3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度 mol/L.(计算出结果到小数点后二位)
|
|
| 20. | 详细信息 |
|
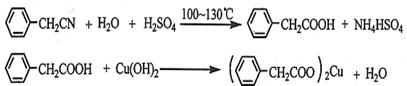
(1)下列物质(括号中的为杂质)请指出除杂所用试剂及操作方法。 乙烷(乙烯): ;乙酸乙酯(乙酸): ; 苯(苯酚): ;乙醇(水): 。 (2)苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
制备苯乙酸的装置如图(加热和夹持装置等略): 已知:苯乙酸的熔点为76.5 ℃,微溶于冷水(溶解度随温度的升高而变大),溶于乙醇。 回答下列问题: ①在250 mL三颈烧瓶a中加入70 mL70%硫酸(反应中硫酸足量)。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是 。 ②将a中的溶液加热至100 ℃,用仪器b缓缓滴加46.8g苯乙腈到硫酸溶液中,然后升温至130 ℃ 继续反应。在装置中,仪器c的名称是 ,其进出水方向是 。反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是 。下列仪器中可用于分离苯乙酸粗品的是 (填标号)。 A分液漏斗 B漏斗 C烧杯 D直形冷凝管 E玻璃棒 ③提纯粗苯乙酸的方法是 ,最终得到44 g纯品,则苯乙酸的产率是(结果保留两位有效数字)。 ④用CuCl2• 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是 。 ⑤将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是 。
|
|
| 21. | 详细信息 |
|
Ⅰ:(4分)若取4.00mol/L的氨水30.0mL与70.0mL2.00mol·L-1的AlCl3溶液相混合,产生白色沉淀的质量是 g Ⅱ:(6分)实验室用4.35gMn02与l00 mL11mol/L的浓盐酸(足量)反应制取氯气。 试计算: (1)在标准状况下,生成氯气的体积。(不考虑氯气在溶液中的溶解) (2)将反应后的溶液加水稀释到500mL,向从其中取出的50mL溶液中加入足量AgN03溶液,生成沉淀的物质的量。(要求写出计算过程)
|
|
| 22. | 详细信息 |
|
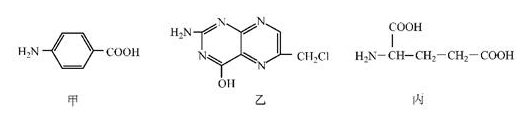
叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成。
(1)甲中显酸性的官能团是 (填名称)。 (2)下列关于乙的说法,正确的是 (填名称)。 a.分子中碳原子和氮原子的个数比是7∶5 b.属于芳香族化合物 c.既能与盐酸又能与氢氧化钠溶液反应 d.属于苯酚的同系物 (3)丁是丙的同分异构体,且满足下列两个条件,丁的结构简式为 。 a.含有H2N-CH-COOH b.在稀硫酸中水解有乙酸生成 (4)甲可以通过下列路线合成(分离方法和其他产物已经略去):
①步骤Ⅰ的反应类型是 。 ②步骤Ⅰ和Ⅳ在合成甲过程中的目的是 。 ③步骤反应的化学方程式为 。
|
|
| 23. | 详细信息 |
|
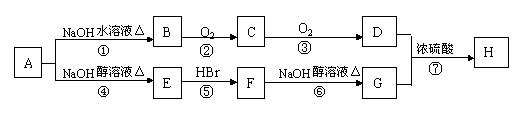
有机物A分子组成为C4H9Br,分子中有一个甲基支链,在一定条件下A发生如下转化:
②连接羟基的碳原子上没有氢原子的醇如: (1)A的结构简式为 B—H中,与A互为同分异构体的有机物是 (填字母代号) (2)上述转化中属于取代反应的有 (填序号) (3)C的结构简式为 (4)写出反应④的化学方程式 ,
|
|
| 24. | 详细信息 |
|
由乙烯和其他无机原料合成环状酯.其合成过程如下(水及其他无机产物均已省略)
请分析后回答下列问题: (1)写出下列反应的反应类型:① ② ; (2)D物质中的官能团名称为 ; (3)物质X与A互为同分异构体,则X的结构简式为 ; (4)写出下列转化的化学方程式:A→B ; B+D→E 。
|
|
- 2017-2018年高一上学期期中考试化学考试(西藏林芝市第二中学)
- 2018年高考化学二轮专题复习 综合复习:有机化学(备考)
- 2017-2018年高三前半期化学期中考试考试题(吉林省白山市抚松五中、长白山实验中学、长白山二中、长白山实验中学联考)
- 2019届高三9月月考化学题开卷有益(山西省朔州市应县第一中学)
- 北京高二化学期末考试(2018年下期)试卷带答案和解析
- 高中化学人教版 必修2 第一章 物质结构 元素周期律 第二节 元素周期律 元素周期表和元素周期律的应用
- 2016-2017年高一上册化学期中考试考试题(山东省德州市陵城一中)
- 2017-2018年高二上册第二次阶段性考试化学试卷(安徽省六安市第一中学)