2013四川高一上学期人教版高中化学期中考试
| 1. | 详细信息 | ||||||||||||||||||||
|
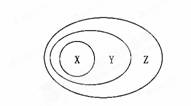
用下图表示的一些物质或概念之间的从属或包含关系中不正确的是
|
|||||||||||||||||||||
| 2. | 详细信息 |
|
科学的分类方法可提高学习效率,以达到事半功倍的效果。下列分类标准合理的是 ①根据氧化物的元素组成将氧化物分为金属氧化物和非金属氧化物②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 ③根据分散系是否有丁达尔效应来区分溶液、胶体 ④根据物质溶于水或熔化状态是否导电分为电解质和非电解质 A.①②④ B.①② C.①②③ D.①②③④
|
|
| 3. | 详细信息 |
|
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是 A.Cu(OH)2与盐酸,Cu(OH)2与醋酸 B.BaCl2溶液与Na2SO4溶液,Ba(OH) C.NaHCO3溶液与NaHSO4溶液,NaHCO3溶液 D.石灰石与稀硝酸反应,生石灰与稀盐酸
|
|
| 4. | 详细信息 |
|
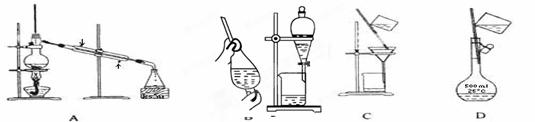
、以下实验装置一般不用于分离物质的是
|
|
| 5. | 详细信息 |
|
在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是
B.硫酸铜溶液中逐滴加入氢氧化钡溶液 C.硫酸中逐滴加入氨水 D.盐酸中逐滴加入硝酸银溶液
|
|
| 6. | 详细信息 |
|
设NA为阿伏加德罗常数的数值,下列说法正确的是 A.1 mol Fe2+被足量的H2O2溶液氧化,转移2NA个电子 B.1 L 0.1 mol·L-1氨水含有0.1NA个OH- C.1molFeCl3与沸水反应生成NA个Fe(OH)3胶粒 D.常温下,23 g NO2含有NA个氧原子
|
|
| 7. | 详细信息 |
|
下列说法中正确的是 A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol·L-1 B.从1 L 2 mol·L-1的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol·L-1 C.配制500 mL 0.5 mol·L-1的CuSO4溶液,需62.5 g胆矾 D.中和100 mL 1 mol·L-1的H2SO4溶液,需NaOH 4 g
|
|
| 8. | 详细信息 |
|
下列说法正确的是 A.同温同压下,相同数目的分子必具有相同的体积 B.等质量的O2和H2的物质的量之比为16∶1 C.不同的气体若体积不等,则它们所含的分子数一定不等 D.同温同体积下,两种气体的物质的量之比等于压强之比
|
|
| 9. | 详细信息 |
|
下列叙述正确的是 A.元素的单质一定由氧化或还原该元素的化合物制得 B.在化学反应中,得电子越多的氧化剂,其氧化性就越强 C.阳离子只能得到电子被还原,阴离子只能失去电子被氧化 D.含有最高价元素的化合物不一定具有很强的氧化性
|
|
| 10. | 详细信息 |
|
下列反应中必须加入还原剂才能进行的是 A.H2O→H2 B.Zn→ Zn2+ C.Fe3+→Fe D.CuO→CuCl2
|
|
| 11. | 详细信息 |
|
从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是 A.2NaBr+Cl2=2NaCl+Br2 B.AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl C.2H2S+SO2=2H2O+3S↓ D.3NO2 + H2O = 2HNO3 + NO
|
|
| 12. | 详细信息 |
|
A.虽然石墨有较好的导电性,但它属于非电解质 B.实验测定NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质 C.实验测定液态HCl、固体NaCl均不能导电,所以HCl、NaCl均是非电解质 D.蔗糖(纯净物)在水溶液或熔融状态下均不能导电,所以蔗糖属于非电解质
|
|
| 13. | 详细信息 |
|
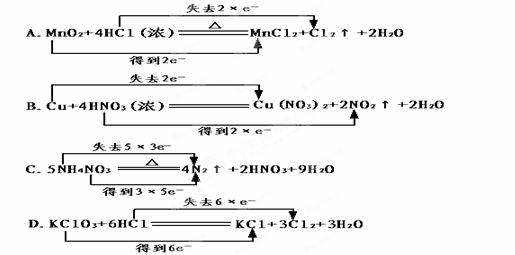
下列化学方程式中电子转移不正确的是
|
|
| 14. | 详细信息 |
|
xR2++yH++O2 === mR3++nH2O中,对 A.m=4,R3+是还原产物 B.2m=y,R2+是氧化剂 C.m=4,R3+是氧化产物 D.m=
|
|
| 15. | 详细信息 |
|
下列离子方程式中正确的是 A.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO B.向NaOH溶液中滴入少量Ca(HCO3)2溶液:Ca2++HCO C.Na2CO3溶液中通入CO2:CO D.CH3COOH溶液与NaOH溶液反应:H++OH-===H2O
|
|
| 16. | 详细信息 |
|
在溶液中能大量共存,若加入OH-就有沉淀析出,若加入H+就能放出气体的是 A.Mg2+、Na+、Cl-、CO32- C.H+、Al3+、N
|
|
| 17. | 详细信息 |
|
下列各组微粒中,在一定条件下均可以作氧化剂的是 A.Fe、H2O、CO2 B.Fe3+、MnO C.Cl2、HClO、Mg D.ClO-、Cl-、Ag+
|
|
| 18. | 详细信息 |
|
下列说法中正确的是: A.蒸馏实验中为了温度测量准确,温度计的水银球应伸入液面以下
C.选择萃取剂将碘水中的碘萃取出来,这种萃取剂必须是不溶于 水且密度比水小 D.装运浓硫酸的包装箱应贴的图标为(如右图)
|
|
| 19. | 详细信息 |
|
M(NO3)2热分解化学方程式为:2M(NO3)2 A.24g/mol B.40g/mol C.64g/m
|
|
| 20. | 详细信息 |
|
有下列三个反应: ①Cl2+FeI2===FeCl2+I2 ②2Fe2++Br2===2Fe3++2Br- ③Co2O3+6HCl===2CoCl2+Cl2↑+3H2O 下列说法正确的是 A.①②③中的氧化产物分 B.根据以上方程式可以得到氧化性Cl2>Fe3+>Co2O3 C.可以推理得到Cl2+FeBr2===FeCl2+Br2 D.在反应③中当1 mol Co2O3参加反应时,2 mol HCl被氧化
|
|
| 21. | 详细信息 |
|
制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生反应2FeCl3+Cu====2FeCl2+CuCl2。FeCl3溶液跟铁粉也能反应2FeCl3+Fe====3FeCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是 A.烧杯中有铜无铁 B.烧杯中有铁无铜 C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
|
|
| 22. | 详细信息 |
|
.某金属的硝酸盐受热分解生成NO2、O2和该金属的氧化物。已知NO2和O2的分子个数比为8∶1,则在分解过程中该金属的化合价将 A.无法确定 B.升高 C.不变 D.降低
|
|
| 23. | 详细信息 |
|
亚硝酸(HNO2)既可作氧化剂又可作还原剂,当它在反应中作氧化剂时,可能生成的产物是 A. N2 B. N2O3 C. NH3 D. NO2
|
|
| 24. | 详细信息 |
|
在NaCl和Na2SO4的混合液中,当Cl—的物质的量浓度是Na+的物质的量浓度的0.6倍时,下列叙述正确的 A.溶液中可能含有0.5mol N B.SO42-离子和Cl-离子的物质的量之和等于Na+的物质的量 C.SO42-所带的电荷数是Na+所带的电荷数的3/5倍 D.Na2SO4和NaCl物质的量浓度之比为1:3
|
|
| 25. | 详细信息 |
|
下列表示对应化学反应的离子方程式正确的是 A.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I 2+6OH- B.向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++2OH-+HCO3- C.将过量二氧化碳气体入冷氨水中:CO2+NH3·H2O=HCO3-+NH4+ D.用稀硝酸洗涤试管内壁的银单质:Ag+2H++NO3-=Ag++NO↑+H2O
|
|
| 26. | 详细信息 | ||||||||
|
现有下列物质:①NaCO3•10H2O晶体 ②铜 ③氯化氢 ④CO2 ⑤NaHSO4 固体 ⑥Ba(OH)2 (1)按物质的分类方法填写表格的空白处:(填编号)
(2)上述物质中有物质之间可发生离子反应:H++OH- (3)⑩在水中的电离方程式为 ,17.1g⑩溶于水配成250mL溶液, SO42-的物质的量浓度为 。 (4)区别⑦和⑨的方法是 ,将⑨滴加到⑦中至过量的实验现象是 (5)②与⑨发生反应的化学方程式为: 2KMnO4 + 16HCl ══ 2KCl+2MnCl2+5Cl2↑+ 8H2O 上述反应的离子方程式 ,还原产物是 (填化学式)。 体现的盐酸的性质有 (6)向⑧中通入③至恰好完全反应,则⑧的导电能力的变化为 (7)将⑥的溶液滴加到⑤的溶液中至恰好沉淀为止时的离子方程式为 。 (8)用 a应用托盘天平称取Na2CO3·10H2O晶体______g。 b配制Na2CO3溶液时需用的主要仪器有托盘天平、烧杯、药匙、________、________、________。 c实验中下列情况会使所配溶液浓度偏低的是________ A.加水时超过刻度线 B.洗涤液未移入容量瓶 C.容量瓶内壁附有水珠而未干燥 D.定容时俯视刻度线
|
|||||||||
| 27. | 详细信息 |
|
氧化还原反应在生产和生活中使用非常广泛。 I(4分)、一个体重50 kg的健康人含铁2 g,这2 g铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的 (1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是__________。 A. Fe B. Fe2+ C. Fe3+ (2)工业盐的主要成分是NaNO2,以前有许多起因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有________性。下列也能实现这种转化的物质是________。 A. Cl2 B. O2 C. FeCl3 D.浓硫酸 (3)工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有_ II(8分)、某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(As——砷)
|
|
| 28. | 详细信息 | |||||||||||||||
|
将MgCl2溶液加入NaOH和Na2CO3的混合溶液中,溶液中的离子反应如下:先发生Mg2++2OH-===Mg(OH)2↓,后发生Mg2++CO
(1)分 (2)分别是0.50 mol· L-1的以上四种离子在液氨中发生反应的离子方程式是________________ II(6分 Fe3+、Ba2+、K+、OH-、NO3-、
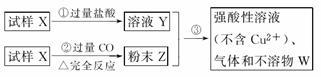
①仔细观察,该溶液呈无色、透明、均一状态。 ②向100mL溶液中滴入稀硫酸,有23.3g白色沉淀产生,再加稀硝酸,白色沉淀不消失。回答下列问题:由此可知,除了含有Na+、Mg2+、Cl-外,该溶液中肯定还含有的离子及其物质的量浓度为___________,肯定没有的离子是___________,可能含有的离子是___________。 III(6分).试样X由氧化亚铁和氧化铜组成。取质量相等的两份试样进行下图所示实验:
(1)写出步骤③发生的全部反应的离子方程式。 (2)若Y和Z充分反应,生成的不溶物的质量是m,则每份试样X中氧化铜的质量为 (用m表示)。
|
||||||||||||||||