2017新疆高二下学期人教版高中化学月考试卷
| 1. | 详细信息 | ||||||||
|
古丝绸之路贸易中的下列商品,主要成分属于无机物的是
|
|||||||||
| 2. | 详细信息 |
|
2016年IUPAC命名117号元素为Ts(中文名“ A.Ts是第七周期第ⅦA族元素 B.Ts的同位素原子具有相同的电子数 C.Ts在同族元素中非金属性最弱 D.中子数为176的Ts核素符号是
|
|
| 3. | 详细信息 |
|
下列物质分类正确的是 A.SO2、SiO2、CO均为酸性氧化物 B.稀豆浆、硅酸、氯化铁溶液均为胶体 C.烧碱、冰醋酸、四氯化碳均为电解质 D.福尔马林、水玻璃、氨水均为混合物
|
|
| 4. | 详细信息 |
|
化学与科学、技术、社会、环境密切相关,下列有关说法不正确的是 A.光导纤维的主要成分是SiO2,太阳能电池的主要成分是单质硅 B.墨水是一种胶体,不同墨水混用时可能使钢笔流水不畅或者堵塞 C.食品包装袋内常用硅胶、生石灰和还原铁粉三类小包,其作用相同 D.利用铝制容器盛装浓硫酸的原因不是浓硫酸跟铝不反应,而是发生钝化
|
|
| 5. | 详细信息 |
|
设NA为阿伏加德罗常数的数值,下列说法正确的是 A.Na2O2和KMnO4分别制得1 mol O2转移的电子数均是4 NA B.标准状况下,11.2 L乙烯和环丙烷(C3H6)的混合气体中,共用电子对的数目为3 NA C.用惰性电极电解1L 0.1mol·L-1的食盐水,两极共收集到0.28 mol的气体,则电路中转移电子数为0.34 NA(不考虑气体的溶解) D.若1 L 0.2 mol/L的FeCl3溶液完全水解形成胶体,则胶体微粒数0.2 NA
|
|
| 6. | 详细信息 |
|
设NA为阿伏加德罗常数的数值,下列说法正确的是 A.0.5mol/L亚硫酸溶液中含有的H+数小于NA B.12g石墨烯(单层石墨)中含有六元环的个数为1.5NA C.1.2g镁在足量的氧气中燃烧,转移的电子数为0.1NA D.标准状况下,2.24 LCHCl3含有的共价键数目为0.4NA
|
|
| 7. | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列叙述正确的是 A.25 ℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA B.标准状况下,22.4 L NO与11.2 L O2混合后气体的分子数小于NA C.标准状况下,22.4 L己烷中共价键数目为19NA D.常温常压下,将0.1 mol Fe投入足量的浓硝酸中,转移的电子数为0.3NA
|
|
| 8. | 详细信息 |
|
人造空气(氧气与氦气的混合气)可用于减轻某些病痛或供深水潜水员使用。标准状况下, 5.6 L “人造空气”的质量是2.4 g,其中氧气与氦气的质量比是 A.1∶1 B.1∶4 C.2∶1 D.2∶3
|
|
| 9. | 详细信息 | |||||||||||||||
|
下列实验操作规范且能达到目的的是
|
||||||||||||||||
| 10. | 详细信息 |
|
3 g镁铝合金与100 mL稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐17.4 g,则原硫酸的物质的量浓度为 A.1 mol·L-1 B.1.5 mol·L-1 C.2 mol·L-1 D.2.5 mol·L-1
|
|
| 11. | 详细信息 |
|
某同学购买了一瓶“84消毒液”,包装说明如下: 净含量:1 000 mL 密度:1.19 g·cm-3 主要成分:25%NaClO 使用方法:稀释100倍(体积比)后使用 注意事项:密封保存,易吸收空气中的CO2变质 请根据以上信息和相关知识判断,下列分析不正确的是 A.该“84消毒液”的物质的量浓度约为4.0 mol·L-1 B.一瓶该“84消毒液”敞口放置一段时间后浓度会变小 C.取100 mL该“84消毒液”稀释100倍后用以消毒,稀释后的溶液中c(Na+)约为0.04 mol·L-1 D.参阅该“84消毒液”的配方,欲用NaClO固体配制含25%NaClO的消毒液480 mL,需要称量的NaClO固体质量为143 g
|
|
| 12. | 详细信息 |
|
在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含NH A.溶质的质量分数w= B.溶质的物质的量浓度c= C.溶液中c(OH-)= D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
|
|
| 13. | 详细信息 |
|
下列反应可用离子方程式“H++OH−=H2O” 表示的是 A. NaHSO4溶液与Ba(OH)2溶液混合 B.NH4Cl溶液与Ca(OH) 2溶液混合 C. HNO3溶液与KOH溶液混合 D. Na2HPO4溶液与NaOH溶液混合
|
|
| 14. | 详细信息 |
|
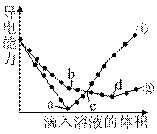
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶
下列分析不正确的是 A.①代表滴加H2SO4溶液的变化曲线 B.b点,溶液中大量存在的离子是Na+、OH– C.c点,两溶液中含有相同量的OH– D.a、d两点对应的溶液均显中性
|
|
| 15. | 详细信息 |
|
制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。高温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是 A.通入过量Cl2:Fe2+、H+、NH B.加入少量NaClO溶液:NH C.加入过量NaOH溶液:Na+、Fe2+、NH D.加入过量NaClO和NaOH的混合溶液:Na+、SO
|
|
| 16. | 详细信息 |
|
下列指定反应的离子方程式正确的是 A.氯气溶于水:Cl2+H2O===2H++Cl-+ClO- B.Na2CO3溶液中CO C.酸性溶液中KIO3与KI反应生成I2:IO D.NaHCO3溶液中加足量Ba(OH)2溶液:HCO
|
|
| 17. | 详细信息 |
|
下列有关实验操作的叙述错误的是 A.过滤操作中,漏斗的尖端应接触烧杯内壁 B.从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁 C.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 D.向容量瓶转移液体时,引流用玻璃棒可以接触容量瓶内壁
|
|
| 18. | 详细信息 |
|
在给定的条件下,下列选项所示的物质间转化均能实现的是 A. SiO2 B. FeS2 C. N2 D. MgCO3
|
|
| 19. | 详细信息 |
|
下列实验操作能达到实验目的的是 A.用长颈漏斗分离出乙酸与乙醇反应的产物 B.用向上排空气法收集铜粉与稀硝酸反应产生的NO C.配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 D.将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2
|
|
| 20. | 详细信息 |
|
右表为元素周期表中短周期的一部分,其中Y元素的核电荷数为M与N元素核电荷数之和。下列说法正确的是 A.氢化物稳定性:N>Z,因为N的氢化物中存在氢键 B.简单离子半径:N>X,是因为它们具有相同的电子层结构且 X的核电荷数更大 C.元素的非金属性:M>Y,是因为M单质能与YN2反应生成Y单质 D.熔沸点:YN2>MN2,是因为YN2的分子间作用力强
|
|
| 21. | 详细信息 |
|
A、B、C、D、E是五种短周期元素,A的某种原子失去一个电子后可形成一个质子,B的某种单质是自然界中最硬的物质,C的某种单质是生物呼吸必需的气体,D元素的K层和M层电子数相同,E是短周期金属性最强的元素。下列说法正确的是 A.C、D、E的简单离子半径由大到小的顺序是E>D>C B.含有E的盐溶液可能显酸性、可能显中性、也可能显碱性 C.A和C形成的化合物中一定只有极性键 D.BC2跟C、E形成的化合物发生的反应都是非氧化还原反应
|
|
| 22. | 详细信息 |
|
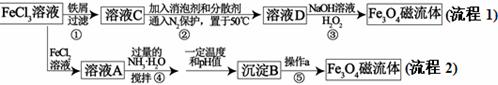
纳米磁性流体材料广泛应用于减震、医疗器械、声音调节等高科技领域。下图是制备纳米Fe3O4磁流体的两种流程:
(1)分析流程图中的两种流程,其中_________(填“流程1”、“流程2”)所有反应不涉及氧化还原反应。步骤①反应的离子方程式为 。 (2)步骤②保持50℃的做法是 。 (3)步骤③中加入的H2O2电子式是_______,步骤③制备Fe3O4磁流体的化学方程式为 。 (4)流程2中FeCl3和FeCl2制备Fe3O4磁流体,理论上FeCl3和FeCl2物质的量之比为 _____。已知沉淀B为四氧化三铁,步骤⑤中操作a具体的步骤是 。 (5)利用K2Cr2O7可测定Fe3O4磁流体中的Fe2+含量。若Fe3O4磁流体与K2Cr2O7充分反应消耗了0.01 mol·L-1的K2Cr2O7标准溶液100 mL,则磁流体中含有Fe2+的物质的量为 mol。若配制的K2Cr2O7标准溶液装在__________(填“酸式滴定管”或“碱式滴定管”)时,滴定前平视刻度线,滴定后仰视刻度线,则测定结果是Fe3O4磁流体中的Fe2+含量 (填“偏大”、“偏小”或“不变”)。
|
|
| 23. | 详细信息 |
|
前四周期元素A、B、C、D、E、F的原子序数依次增大,A是宇宙中含量 最丰富的元素;B和C同一主族,且B的L层电子数是K层电子数的2.5倍;D和C同 一周期;E元素原子核外电子有17种不同的运动状态,F位于第四周期,其未成对电子 数只有一个,且内层都处于全充满状态。请回答下列问题: (1)B原子的L层轨道表达式_________;D元素原子的价电子排布式是 。 (2)由A、B原子形成的分子的结构式为:A-B=B-A,则该分子中σ键和π键的数目之比为 , B、C的氢化物中BH3的沸点高于 CH3的沸点,原因是______;C、D和E的电负性由大到小的顺序为 ;C、D和E的第一电离能由大到小的顺序是 ;C和D最高价含氧酸的酸性由弱到强的顺序为 。CO (3)向FDO4溶液中加入过量稀氨水,得到的深蓝色溶液中阳离子化学式为 ,该离子的配位体为 。 (4)D(黑球)和F(白球)形成的某种晶体的晶胞如右图所示,已知该晶胞的棱长为516 pm,则该晶胞的密度为 g/cm3,(列出计算式即可,不必计算结果,阿伏加德罗常数值为NA),最近的黑球和白球之间的距离为 pm。
|
|
| 24. | 详细信息 |
|
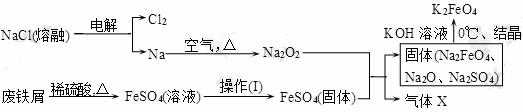
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。 (1)工业上的湿法制备方法是用KClO与Fe(OH)3在KOH存在下制得K2FeO4,该反应氧化剂与还原剂物质的量之比为____________。 (2)实验室用食盐、废铁屑、硫酸、KOH等为原料,通过以下过程制备K2FeO4: ①操作(Ⅰ)的方法为_______________,隔绝空气减压干燥。 ②检验产生X气体的方法是_____________。 ③最终在溶液中得到K2FeO4晶体利用的原理是_____________。 (3)测定某K2FeO4样品的质量分数,实验步骤如下: 步骤1:准确称量1.0g样品,配制100mL溶液; 步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中; 步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-; 步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+; 步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol·L-1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)溶液的体积,做3次平行实验,平均消耗30.00 mL的(NH4)2Fe(SO4)2溶液。 已知:滴定时发生的反应为:6Fe2++Cr2O72-+14H+==6Fe3++2Cr3++7H2O。 ①步骤2中准确量取25.00mL K2FeO4溶液加入到锥形瓶中所用的仪器是________。 ②写出步骤3中发生反应的离子方程式________________________。 ③步骤5中能否不加指示剂 (填“能”或“否”),原因是___________。 ④根据上述实验数据,测定该样品中K2FeO4的质量分数为__________。 (4)配制0.1mol·L-1的K2FeO4,调节溶液pH,含铁离子在水溶液中的存在形态如图所示。下列说法正确的是_________(填字母)。
A.pH=2时,c(H3FeO4+)+c(H2FeO4)+c(HFeO4-)=0.1mol·L-1 B.向pH=10的这种溶液中加硫酸铵,则HFeO4-的分布分数逐渐增大 C.向pH=1的溶液中加HI溶液,发生反应的离子方程式为:H2FeO4+H+==H3FeO4+ D.将K2FeO4晶体溶于水,水溶液呈弱碱性
|
|
| 25. | 详细信息 |
|
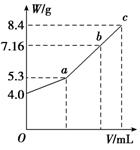
钠有多种化合物,如氧化钠、过氧化钠、氢氧化钠、碳酸钠、碳酸氢钠等等,这些物质在实际生活中有广泛的应用,一定条件下相互间能进行转化。完成下列计算: (1)将7.8 g Na2O2完全溶于93.8 g水中,所得溶液中溶质的质量分数为________。 (2)将11.6 g二氧化碳和水蒸气的混合物与足量的Na2O2充分反应,固体质量增加了3.6 g,则原混合气体的平均相对分子质量为________。
(a)推断b点时M的组成成分_________。(填化学式,下同) (b)若向b点的盐溶液中只加入0.03 mol某钠的化合物,充分反 应后,减压低温蒸发得到无水Na2CO3 8. 48 g,则加入的物
(4)将31 g NaOH和NaHCO3的固体混合物,在密闭容器中加热 到250 ℃,经充分反应后排出气体、冷却,称得剩余固体的质 量为N g,试分析不同N值时,剩余固体的组成成分(已知NaHCO3的分解温度低于250 ℃)________________ ____________。
|
|
- 四川省邻水实验学校2021届高三下册3月开学考试理综化学免费试卷带答案和解析
- 2019-2020年高三前半期期中考试化学题免费试卷(上海市市东中学)
- 2018-2019年高二上期期中考试化学题带答案和解析(福建省三明市第一中学)
- 2019-2020年高二上半年期中考试化学题开卷有益(甘肃省白银市会宁县第四中学)
- 黑龙江省龙东南六校2020-2021年高一上册期末联考化学在线考试题带答案和解析
- 龙泉中学、潜江中学高三化学月考测验(2019年后半期)无纸试卷
- 高一后半期第一次阶段性测试化学题免费在线检测(2018-2019年湖南省长沙市第一中学)
- 2018-2019年高一第一学期期中考试化学考试(上海市海洋大学附属中学)