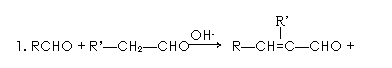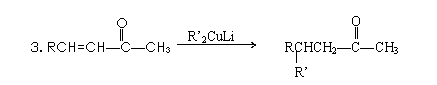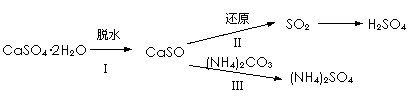2017北京高三下学期人教版高中化学高考模拟
| 1. | 详细信息 | ||||||||
|
下列电池工作时能量转化形式与其它三个不同的是
|
|||||||||
| 2. | 详细信息 |
|
关于a:0.1mol/L NH4Cl溶液和b:0.1mol/L NH3·H2O溶液,下列说法不正确的是 A.两溶液中存在的微粒种类:a>b B.c(NH4+):a>b C.c(OH-):a<b D.水电离出的c(H+):a<b
|
|
| 3. | 详细信息 |
|
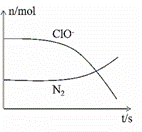
某离子反应涉及到H2O、ClO﹣、NH4+、OH﹣、N2、Cl﹣等微粒,其中N2、ClO﹣的物质的量随时间变化的曲线如右图所示,下列说法正确的是 A.该反应中Cl﹣为氧化产物 B.消耗1 mol还原剂,转移6 mol电子 C.反应后溶液的酸性减弱 D.NH4+被ClO﹣氧化成N2
|
|
| 4. | 详细信息 |
|
下列说法正确的是 A.葡萄糖制镜利用了葡萄糖的氧化性 B.室温下,在水中的溶解度:乙醇>苯酚>乙酸乙酯 C.酯在碱性条件下水解生成对应的酸和醇 D.甲苯能使酸性高锰酸钾溶液褪色,说明甲基使苯环变活泼
|
|
| 5. | 详细信息 | ||||||||||||||||||||
|
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
|
|||||||||||||||||||||
| 6. | 详细信息 | ||||||||||||
|
常温时,用0.1000mol/L NaOH溶液滴定25.00mL 0.1000mol/L某一元酸HX溶液,滴定过程中pH变化曲线如下图所示。下列说法不正确的是 C B A 7.0 NaOH溶液的体积/mL pH A.在A点:c(HX)>c(Na+)>c(X-) B.在B点,溶液中c(H+)=c(OH-)
D.0.05mol/L NaX溶液的pH ≈ 9
|
|||||||||||||
| 7. | 详细信息 |
|
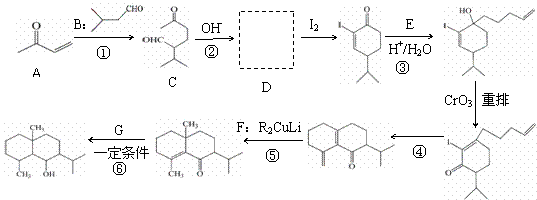
天然产物萜类化合物eudesmane合成路线片段如下。(某些反应条件省略)
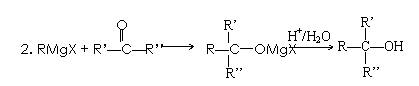
已知:
回答下列问题: (2)反应②的化学方程式是。 (3)反应③中试剂E的结构简式是。 (4)反应④的另一种产物是。 (5)F的结构简式是。 (6)G的电子式是。 (7)D有多种同分异构体,满足下列条件的有种,写出其中任意一种。 a. 能发生银镜反应b. 结构为六元环状c. 环上有3种氢原子 (8)以CH3CH2OH与CH3COCH3为原料,结合已知信息选用必要的无机物合成B,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上标明试剂和反应条件)。
|
|
| 8. | 详细信息 |
|
磷石膏(主要成分是CaSO4·2H2O)是磷酸及磷肥类工业在生产过程中产生的一种废渣,我国每年排放的磷石膏大约2000万吨以上,开发利用磷石膏,保护资源和环境,符合持续发展的观念。下图所示为对磷石膏进行综合利用的路径之一。
(1)过程Ⅰ中CaSO4·2H2O脱水反应相关的热化学方程式为: CaSO4·2H2O(s)=CaSO4· CaSO4·2H2O(s)=CaSO4(s)+2H2O(l) ΔH2=+26 kJ·mol-1 H2O(g)=H2O(l) ΔH3=-44 kJ·mol-1 则反应CaSO4·
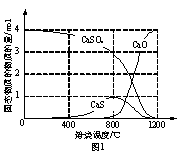
①CO作还原剂,改变反应温度可得到不同的产物。不同温度下所得固体成分的物质的量如右图1所示。在低于800 ℃时还原产物为;1200 ℃时主要发生的反应的化学方程式为。
③以SO2为原料,工业生产硫酸的化学方程式是。 (3)过程III将CaSO4投入(NH4)2CO3溶液中,发生反应的离子方程式是。
|
|
| 9. | 详细信息 | |||||||||||||
|
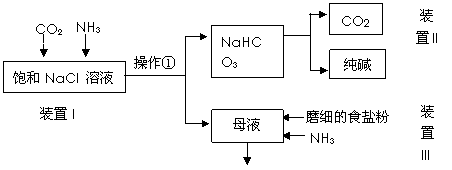
纯碱是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用。 (1)工业生产纯碱的第一步是除去饱和食盐水的中Mg2+、Ca2+离子,从成本角度考虑加入试剂的化学式为、。 某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如下:
已知:几种盐的溶解度
(2)①写出装置I中反应的化学方程式。 ②从平衡移动角度解释该反应发生的原因。 ③操作①的名称是。 (3)写出装置II中发生反应的化学方程式。 (4)请结合化学用语说明装置III中加入磨细的食盐粉及NH3的作用。 (5)该流程中可循环利用的物质是。 (6)制出的纯碱中含有杂质NaCl,为测定其纯度,下列方案中不可行的是。 a.向m克纯碱样品中加入足量CaCl2溶液,测生成CaCO3的质量 b.向m克纯碱样品中加入足量稀H2SO4,干燥后测生成气体的体积 c.向m克纯碱样品中加入足量AgNO3溶液,测生成沉淀的质量
|
||||||||||||||
| 10. | 详细信息 | |||||||||||||||||||||||||||||||||||||||||||||||||||||
|
某研究小组为了验证反应物浓度对反应速率的影响,选用硫酸酸化的高锰酸钾溶液与草酸溶液在室温下进行反应。 实验中所用的草酸为稀溶液,可视为强酸。 (1)将高锰酸钾氧化草酸的离子方程式补充完整。
(2)该小组进行了实验I,数据如下。
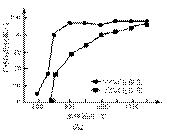
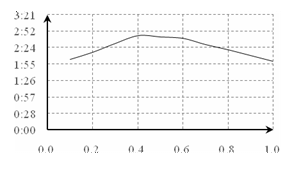
一般来说,其他条件相同时,增大反应物浓度,反应速率。 但分析实验数据,得到的结论是。 (3)该小组欲探究出现上述异常现象的原因,在实验I的基础上,只改变草酸溶液浓度进行了实验II,获得实验数据并绘制曲线图如下。 O N 草酸溶液浓度与反应用时曲线图 草酸的物质的量浓度(mol/L) M ①用文字描述曲线图表达的信息。 ②该小组查阅资料获取如下信息,其中能够解释MO变化趋势的是。
(4)该小组为探究ON段曲线变化趋势的原因,又进行了实验III,所得数据如下。
该小组进行实验III的目的是。 (5)综合实验I、II、III,推测造成曲线MN变化趋势的原因。 为验证该推测还需要补充实验,请对实验方案进行理论设计。
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||