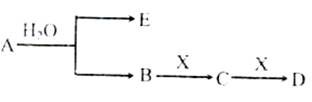2017高二下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
化学与生活、社会发展息息相关。下列说法不正确的是( ) A. “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 B. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 C. “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 D. 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
|
|
| 2. | 详细信息 |
|
高一学生小强的化学笔记中有如下内容:你认为他的笔记中有几处错误( ) ①物质按照组成可以分为单质和化合物 ②单质又可分为金属和非金属 ③化合物主要包括:酸、碱、盐和氧化物 ④按照分散剂粒子直径大小可将分散系分为溶液、浊液和胶体 ⑤只要在水溶液中能导电的化合物就是电解质 ⑥按照树状分类法可将化学反应分为:氧化还原反应和离子反应 ⑦氧化还原反应的本质是化合价升降. A. 三处 B. 四处 C. 五处 D. 六处
|
|
| 3. | 详细信息 |
|
设NA为阿伏加徳罗常数的值。下列说法正确的是( ) A. 1molNa2O2固体中含离子总数为4 NA B. 分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g C. 28g由C2H4和C3H6组成的混合物中含有氢原子的数目为4NA D. 常温下,1mol Fe与过量浓HNO3反应,转移电子的数目为3 NA
|
|
| 4. | 详细信息 |
|
下列指定反应的离子方程式表达正确的是( ) A. FeCl3溶液中加入KSCN溶液:Fe3++ 3SCN-= Fe(SCN)3↓ B. Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+ 2OH-= CaCO3↓+ CO32-+ H2O C. 向NaClO溶液中通入少量SO2: 2ClO-+SO2 +H2O =SO32-+2HClO D. 过量的CO2通入水玻璃中:SiO32-+2CO2+2 H2O =H2SiO3↓ + 2HCO3-
|
|
| 5. | 详细信息 |
|
已知在碱性溶液中可发生如下反应:2R(OH)3+3ClO﹣+4OH﹣═2RO4n﹣+3Cl﹣+5H2O,则RO4n﹣中R的化合价是( ) A. +3 B. +4 C. +5 D. +6
|
|
| 6. | 详细信息 |
|
使相同物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl-离子完全沉淀时,若所用相同浓度的AgNO3溶液的体积比为2:2:1,则上述三种溶液的体积比是( ) A. 9:3:1 B. 3:2:1 C. 6:3:1 D. 9:4:1
|
|
| 7. | 详细信息 |
|
下列关于碳酸钠和碳酸氢钠的叙述,正确的是( ) A. 常温时,在水中的溶解性:碳酸钠>碳酸氢钠 B. 热稳定性:碳酸钠<碳酸氢钠 C. 质量相同时,分别与同体积同浓度盐酸反应的快慢:碳酸钠>碳酸氢钠 D. 物质的量相同时,分别与足量的盐酸反应,生成CO2的质量:碳酸钠<碳酸氢钠
|
|
| 8. | 详细信息 |
|
下列各组离子在指定溶液中能大量共存的是( ) A. 无色溶液中:K+、Na+、MnO4﹣、SO42﹣ B. 酸性溶液中:K+、Cl﹣、NO3﹣、Fe2+ C. 加入 Al 能放出 H2的溶液中:Cl﹣、HCO3﹣、SO42﹣、NH4+ D. 在酸性溶液中:Mg2+、Na+、SO42﹣、Cl﹣
|
|
| 9. | 详细信息 |
|
用高铁酸钠(Na2FeO4)对河、湖水消毒是城市饮用水处理的新技术,已知反应:Fe2O3+3Na2O2=2Na2FeO4+Na2O.下列说法正确的是( ) A. Na2O2既是氧化剂又是还原剂 B. Fe2O3在反应中显氧化性 C. 1molNa2O2发生反应,有4mol电子转移 D. 在Na2FeO4能消毒杀毒是因其具有强氧化性
|
|
| 10. | 详细信息 |
|
工业上用金红石(主要成分TiO2)制金属钛可通过一下反应进行: ①TiO2+2C+2Cl2 对于上述两个反应的叙述正确的是( ) A. 都是置换反应 B. 都是氧化还原反应 C. 反应中钛元素都被还原 D. 加热时金属钛和氩气(Ar)能反应
|
|
| 11. | 详细信息 |
|
油条的做法是将矾、碱、盐按比例加入温水中,再加入面粉搅拌成面团;放置,使面团产生气体,形成孔洞。放置过程发生反应: 2KAl(SO4)2·12H2O+3Na2CO3 = 2Al(OH)3↓+3Na2SO4+K2SO4+3CO2↑+21H2O.下列有关判断正确的是( ) A. 放置过程发生的反应中,反应物和生成物均为电解质 B. 放置过程发生的反应为氧化还原反应 C. 从物质的分类角度来看,油条配方中的“矾、碱、盐”均为盐 D. 反应的离子方程式为2Al3++3CO32﹣═2Al(OH)3↓+3CO2↑
|
|
| 12. | 详细信息 |
|
我国晋代《抱朴子》中描述了大量的化学反应,其中有:①“丹砂(HgS)烧之成水银,积变又还成丹砂”; ②“以曾青涂铁,铁赤色如铜”。下列有关叙述正确的是( ) A. ①中水银“积变又还成丹砂”说明水银发生了还原反应 B. ②中反应的离子方程式为:2Fe+3Cu2+=2Fe3++3Cu C. 根据①可知温度计打破后可以用硫粉覆盖水银,防止中毒 D. 水银能跟曾青发生置换反应生成单质铜
|
|
| 13. | 详细信息 |
|
制备Fe3O4纳米颗粒的反应为3Fe2++ 2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,下列说法正确的是( ) A. x=2 B. 参加反应的Fe2+全部作还原剂 C. 每生成1 molFe3O4,被S2O32-还原的O2为0.5mol D. 已知Fe3O4纳米颗粒直径为20nm,则Fe3O4纳米颗粒为胶体
|
|
| 14. | 详细信息 |
|
下列有关实验的说法正确的是( ) A. 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,该溶液一定有CO32﹣ B. 为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量 C. 制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中 D. 除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤
|
|
| 15. | 详细信息 |
|
当溶液中XO4-离子与H2O2分子的个数比恰好按2:5进行反应时,溶液中XO4- 被还原为较低价态离子,则X元素的化合价变为( ) A. +1 B. +2 C. +3 D. +4
|
|
| 16. | 详细信息 |
|
已知某金属硝酸盐,在受热分解时生成了金属氧化物、二氧化氮与氧气.测得产物中NO2与O2的体积比为5:1(同温同压下测得),试分析该硝酸盐分解时金属化合价的变化情况是( ) A. 升高 B. 降低 C. 不变 D. 不能确定
|
|
| 17. | 详细信息 |
|
2016年第31届奥运会在巴西里约举行.奥运会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应为:5KC1O3+6P=3P2O5+5KC1.下列有关该反应的叙述中,正确的是( ) A. 氯酸钾是还原剂 B. KCl既是氧化产物,又是还原产物 C. 反应中消耗3mol P时,转移电子的物质的量为15mol D. 发令时产生的白烟只是KCl固体颗粒
|
|
| 18. | 详细信息 |
|
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( ) A. 生成40.0LN2(标准状况) B. 有0.250molKNO3被氧化 C. 转移电子的物质的量为1.25mol D. 反应中共生成0.625mol氧化物
|
|
| 19. | 详细信息 |
|
向含有0.2molFeI2的溶液中加入a molBr2.下列叙述不正确的是( ) A. 当a=0.1时,发生的反应为2I﹣+Br2═I2+2Br﹣ B. 当a=0.25时,发生的反应为2Fe2++4I﹣+3Br2═2Fe3++2I2+6Br﹣ C. 当溶液中I﹣有一半被氧化时,c(I﹣):c(Br﹣)=1:1 D. 当0.2<a<0.3时,溶液中各离子浓度的关系为2c(Fe2+)+3c(Fe3+)+c(H+)═c(Br﹣)+c(OH﹣)
|
|
| 20. | 详细信息 |
|
将一定量的镁铝合金样品分成两等份,一份加入到足量的NaOH溶液中,充分反应后,收集到标准状况下气体6.72L;另一份加入到足量稀盐酸中,充分反应后,收集到标准状况下气体11.2L.则原合金样品中镁的质量为( ) A. 4.8 g B. 6 g C. 9.6 g D. 12 g
|
|
| 21. | 详细信息 |
|
某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32–、Cl–、OH–、NO3–。向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有( ) A. 3种 B. 4种 C. 5种 D. 6种
|
|
| 22. | 详细信息 |
|
质量分数为a%,物质的量浓度为c mol·L-1的NaCl溶液,蒸发溶剂,恢复到原来的温度,若物质的量浓度变为2c mol·L-1,则质量分数变为(蒸发过程中没有晶体析出) ( ) A. 等于2a% B. 大于2a% C. 小于2a% D. 无法确定
|
|
| 23. | 详细信息 |
|
将物质的量均为a mol的钠和铝一同投入m g足量的水中,所得溶液的密度为ρ g/cm3,则此溶液的物质的量浓度为 ( ) A. 1000aρ/ (50a+m) mol/L B. aρ/ (46a+m) mol/L C. 1000aρ/ (46a+m) mol/L D. 1000aρ/ (47a+m) mol/L
|
|
| 24. | 详细信息 |
|
将一定量的Mg和MgO的混合物投入100mL2mol/L的稀盐酸中,完全溶解后,再向反应后的溶液中加入4mol/L的NaOH溶液,要使Mg元素全部沉淀出来,所加入的NaOH溶液的体积最小是( ) A. 100mL B. 50mL C. 25mL D. 无法判断
|
|
| 25. | 详细信息 |
|
在一定条件下,使CO和O2的混合气体26g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14g,则原混合气体中O2和CO的质量比可能是( ) A. 9:4 B. 1:1 C. 7:6 D. 6:7
|
|
| 26. | 详细信息 |
|
某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种,请填写下列空白: (1)不做任何实验就可以肯定原溶液中不存在的离子是___________. (2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失.说明原溶液中肯定存在的离子是_________,有关的离子方程式为_______________. (3)取(2)中的滤液,加入过量的稀氨水(NH3·H2O),出现白色沉淀,说明原溶液中肯定有__________,有关的离子方程式为______________________________. (4)原溶液可能大量存在的阴离子是下列的__________. A.Cl﹣ B.NO3﹣ C.CO32﹣ D.OH﹣
|
|
| 27. | 详细信息 |
|
NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其中一种生产工艺如下:步骤一,利用NaClO3在硫酸作用下与SO2反应生成 ClO2和一种酸式盐。步骤二,将ClO2在NaOH溶液中与H2O2反应即可生成NaClO2 。 回答下列问题: (1)NaClO2中Cl的化合价为_______。 (2)写出步骤一中生成ClO2的化学方程式____________________。 (3) 步骤二反应中氧化剂与还原剂的物质的量之比为_________________,该反应中氧化产物是____________________。 (4)亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数约为________。 (5)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________(填序号)。 A.Cl2 B.H2O2 C.ClO2 D.O3 (6)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O===A+NH3↑,则生成物A的化学式为________,H2O2被称为“绿色氧化剂”的理由是___________________。
|
|
| 28. | 详细信息 |
|
己知:A为含金属离子的淡黄色固体化合物,E、X为空气中常见气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物己略去)。
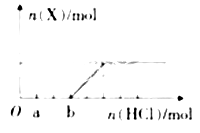
请回答下列问题: (l)这种金属离子的离子结构示意图为______; (2)X的电子式______; (3)B中所含化学键的类型是______;常温常压下,7.8g A与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式______。 (4)①C也可转化为B,写出该转化的化学方程式______; ②B与D反应的离子方程式为______。 (5)将一定量的气体X通入2L B的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如下图(忽略气体的溶解和HCl的挥发)。
请回答:a点溶液中所含溶质的化学式为________,a-b之间的反应的离子方程式_____。
|
|
| 29. | 详细信息 | |||||||||||||||
|
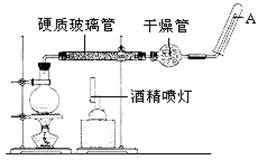
目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
请回答下列的问题: (1)铁在周期表中的位置是________________。 (2)请写出该反应的化学方程式:_____________________________。 (3)曾利用铝和铁的氧化物反应原理来焊接钢轨,该反应的化学方程式为________________________________。 (4)现有铁和铂组成的合金共a mol,其中Pt的物质的量分数为x,研成粉末状后全部投入含bmol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO。试回答下列问题: ①随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有四种情况,请用粒子符号填写下表空白:
②当x=0.5 ,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生112mlNO。 则a =___________,b =______________。
|
||||||||||||||||