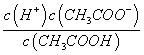2018高三上学期人教版高中化学期中考试
| 1. | 详细信息 |
|
在相同温度时,100 mL 0.01 mol/L的醋酸溶液与10mL 0.l mol/L的醋酸溶液相比较,下列数值前者大于后者的是 A. 中和时所需NaOH的量 B. 与Mg反应的起始速率 C. OH-的物质的量浓度 D. 溶液中
|
|
| 2. | 详细信息 |
|
已知下列反应的能量变化示意图如下:
下列有关说法正确的是 A. l mol S(g)与O2(g)完全反应生成SO2(g) ,反应放出的热量<297.0 kJ/mol B. 在相同条件下,SO3(g)比SO2(g)稳定 C. 1 mol SO2(g)和1/2mol O2(g)生成1mol SO3(g)吸收98.7 kJ/mol D. S(s)与O2(g)反应生成SO3(g)的热化学方程式S(s)+3/2O2(g)
|
|
| 3. | 详细信息 |
|
298 K,l.0l×l05Pa时,反应2N2O5(g) A. 是吸热反应 B. 是放热反应 C. 是熵减小的反应 D. 熵增大效应大于能量效应
|
|
| 4. | 详细信息 |
|
2SO2(g)+O2(g) A. 加入催化剂可加快该反应的速率,从而提高SO2的转化率 B. 增大反应体系的压强,反应速率一定增大 C. 该反应是放热反应,故温度越低,对提高SO3的日产量越有利 D. 在2min时间内,SO2的浓度由6 mol/L变为3 mol/L,则在相同时间段内,SO3(g)生成的平均速率为1.5 mol/(L·min)
|
|
| 5. | 详细信息 |
|
对于反应N2(g)+3H2(g) A. 增大压强,对正反应的反应速率影响更大 B. 升高温度,对正反应的反应速率影响更大 C. 减小反应物浓度,对逆反应的反应速率影响更大 D. 加入催化剂,对逆反应的反应速率影响更大
|
|
| 6. | 详细信息 |
|
甲、乙两个容器内都进行A→B的反应,甲容器内每分钟减少4 molA,乙容器内每分钟减少2 molA,则甲容器内的反应速率比乙容器内的反应速率 A. 快 B. 慢 C. 相等 D. 无法判断
|
|
| 7. | 详细信息 |
|
根据以下3个热化学方程式: 2H2S(g)+3O2(g)= 2SO2(g)+2H2O(l) △H= Q1 kJ/mol 2H2S(g)+O2(g)=2S (s)+2H2O(l) △H= Q2 kJ/mol 2H2S(g)+O2(g)=2S (s)+2H2O(g) △H= Q3 kJ/mol 判断Q1、Q2、Q3三者关系正确的是 A. Q3 >Q2>Q1 B. Q1>Q2>Q3 C. Q1>Q3>Q2 D. Q2>Q1>Q3
|
|
| 8. | 详细信息 |
|
下列物质的电子式书写正确的是( ) A.
|
|
| 9. | 详细信息 |
|
微量元素在人体内含量极少,但它们对于维持生命活动,促进人体健康生长和发 育都有极其重要的作用。下列元素中,若缺乏严重会导致智力损害的是 ( ) A. 钙元素 B. 碘元素 C. 铁元素 D. 钠元素
|
|
| 10. | 详细信息 |
|
蛋白质发生的下列过程中,可逆的是( ) A. 加浓硫酸 B. 变性 C. 颜色反应 D. 盐析
|
|
| 11. | 详细信息 |
|
下列说法正确的是 A. CH3COOH与NaOH在相同条件下电离程度相等 B. NaCl溶液能导电是因为溶液中有Na+和Cl- C. H2SO4在电流作用下在水中电离出H+和SO42- D. NaHCO3在溶液中完全电离为Na+、H+和CO32-
|
|
| 12. | 详细信息 |
|
只能表示一个化学反应的离子方程式为 A. Ba2++SO42-=BaSO4↓ B. 2H++CO32-=H2O+CO2↑ C. Cl2+2Br-=2C1-+Br2 D. SO2+Br2+2H2O=4H++2Cl-+ SO42-
|
|
| 13. | 详细信息 |
|
将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为 A.
|
|
| 14. | 详细信息 |
|
与8g SO3中氧原子数相同的是 A. 9.6g H2SO4 B. 6.6g CO2 C. 6.4g SO2 D. 6.72L CO(常温、常压)
|
|
| 15. | 详细信息 |
|
下列物质中:酒精、硫酸、盐酸、饱和食盐水、SO2、Na2O、NH3、金属铜,属于电解质的数目为 A. 1种 B. 2种 C. 3种 D. 4种
|
|
| 16. | 详细信息 |
|
下列说法中,正确的是[] A. CO2的摩尔质量是44 B. H2O的相对分子质量是18g C. 标准状况下.11.2L SO2与CO2的混合气体含有氧原子的数目约为NA个 D. 标准状况下.4g氢气约含2mol氢
|
|
| 17. | 详细信息 |
|
下列叙述正确的是 A. NaHSO4水溶液能使石蕊变红,但NaHSO4不是酸 B. 有单质参加或有单质生成的反应一定是氧化还原反应 C. 酸性氧化物一定是非金属氧化物 D. 1molCl2的体积是22.4L
|
|
| 18. | 详细信息 |
|
下列有关物质分类的结论正确的是 A. 依据酸在水中的电离程度,将酸分为含氧酸和无氧酸 B. 依据反应过程中是否发生电子的转移,将化学反应分为氧化还原反应和非氧化还原反应 C. 依据组成,将氧化物分为酸性氧化物、碱性氧化物、两性氧化物,不成盐氧化物和特殊氧化物等 D. 依据在反应过程中的得电子数目.将氧化剂分为强氧化剂和弱氧化剂
|
|
| 19. | 详细信息 |
|
已知在温度不变的恒容容器中,X2、Y2两种气体反应生成气体Z时(X2+2Y2=2Z),每个X原子失去2个电子,则下列说法中不正确的是 A. Y2是氧化剂 B. 产物中Y显-1价 C. Z为三原子分子 D. 反应过程中,容器内压强不变
|
|
| 20. | 详细信息 |
|
下列关于胶体的叙述中,正确的是 A. 胶体与溶液和浊液的本质区别是胶体能产生丁达尔效应 B. 胶体稳定的主要原因,是胶体粒子能作布朗运动 C. 面粉厂采用高压除尘的方法,与胶体的性质有关 D. 胶体能发生“电泳”,说明该类分散系带电荷
|
|
| 21. | 详细信息 |
|
在一定温度下,10L密闭容器中加入5.0molSO2、4.5molO2,经10min后反应达到平衡,此时容器中气体的平均分子量为58。请计算(写出计算过程): (1)10min内SO2的转化率; (2)容器内反应前与平衡时的压强之比(最简整数比) ; (3)该温度下的平衡常数。
|
|
| 22. | 详细信息 |
|
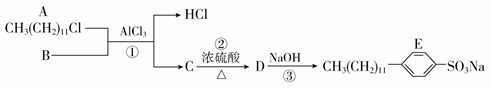
具有去污作用的物质E可通过下列途径合成:
已知: 苯磺酸能溶于NaOH溶液中。 请回答下列问题: (1)A属于________(根据官能团写出其有机物类别)。 (2)烃B的结构简式为________________________,B与C的关系是____________。 (3)分别将B、C加入酸性高锰酸钾溶液中,现象是____________________。 (4)写出反应②的化学方程式:____________________________。 (5)写出A发生消去反应的化学方程式:____________________。
|
|