2017四川高一下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
元素周期表揭示了不同元素之间的内在联系,是化学发展史上重要的里程碑。下列关于元素周期表的叙述中,正确的是( ) A.元素周期表中每一横行为一周期,每一纵列为一族 B.原予最外层电子数相同的元素一定位于元素周期表中的同一主族 C.在元素周期表的过渡元素区域中寻找制备耐高温材料的元素 D.第二周期元素的最高价态都等于其原子最外层电子数
|
|
| 2. | 详细信息 |
|
以下关于锂、钠、钾、铷、铯的叙述不正确的是( ) ①氢氧化物中碱性最强的是CsOH; ②单质熔点最高的是铯; ③与O2反应均可得到多种氧化物; ④它们的密度依次增大,均要保存在煤油中; ⑤其单质的还原性依次增强; ⑥它们对应离子的氧化性依次增强; ⑦单质与水反应的剧烈程度依次增加;⑧单质与相同浓度、相同体积的盐酸溶液反应的剧烈程度依次增加 A.①⑤⑦⑧ B.②⑧⑥ C.②③④⑥ D.②③④
|
|
| 3. | 详细信息 |
|
关于卤族元素氟、氯、溴、碘的叙述中,正确的是( ) ①单质的密度依次增大; ②常温常压下单质分子间的作用力依次增强; ③气态氢化物的稳定性:HF>HCl>HBr>HI; ④非金属性依次增强; ⑤气态氢化物水溶液的酸性:HCl<HBr<HI; ⑥简单离子的还原性:F-<Cl-<Br-<I-; ⑦单质与氢气化合由难到易的顺序为:F2>Cl2>Br2>I2 A.①③⑤⑥⑦ B.①②③⑤ C.①②③④⑥ D.①②③⑤⑥
|
|
| 4. | 详细信息 |
|
下列关于离子化合物和共价化合物的说法正确的是( ) ①离子化合物一定含离子键,也可能含极性键和非极性键; ②共价化合物一定含共价键,也可能含离子键; ③含金属元素的化合物不一定是离子化合物; ④由非金属元素构成的化合物一定是共价化合物; ⑤两种非金属元素能够形成离子化合物; ⑥熔融状态能导电的化合物一定是离子化合物 A.①③⑤⑥ B.①③⑤ C.①⑤⑥ D.①③⑥
|
|
| 5. | 详细信息 |
|
下列有关物质结构的说法正确的是( ) A.78 g Na2O2晶体中所含阴、阳离子个数均为2NA B.3.4 g H2O2中含有0.3 mol化学键 C.CO2的结构式为O-C-O D.PCl3邗BCl3分子中所有原子最外层均达到8电子稳定结构
|
|
| 6. | 详细信息 |
|
原子序数大于4的主族元素X、Y的离子Xm+、Y n-电子层结构相同,则X、Y的下列叙述正确的是( ) ①原子序数X>Y ②X和Y在同一周期 ③Y与X族序数之差是8-(m+n) ④X、Y核电荷数差为(m-n) A.①③ B.②④ C.①② D.①④
|
|
| 7. | 详细信息 |
|
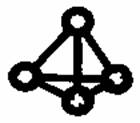
意大利罗马大学的科学家获得了极具理论研究意义的N4分子,N4分子结构如右图所示。下列有关N4的说法正确的是( )
A.N4是一种新型的化合物 B.N4分子中只含有非极性键 C.N4的沸点比P4(白磷)高 D.1mol N4中含有9 mol共价键
|
|
| 8. | 详细信息 |
|
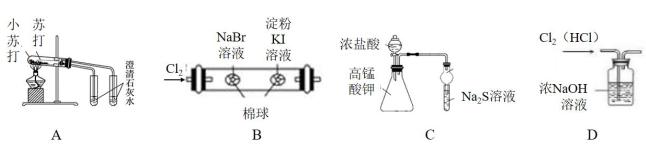
下列图中的实验,能达到实验目的的是( )
A.证明稳定性:Na2CO3 >NaHCO3 B.证明非金属性:Cl>Br>I C.证明氧化性:Cl2>S D.除去Cl2中的杂质气体HCl
|
|
| 9. | 详细信息 |
|
铊盐为A级危险品,铊(Tl)的原子序数为81,Tl3+与Ag在酸性溶液中发生反应:Tl3+ + 2Ag =Tl++ 2Ag+且已知Ag++ Fe2+= Ag+ Fe3+,则下列推断正确的是( ) A.Tl+的最外层有3个电子 B.氧化性:Tl3+>Ag+> Fe3+ C.Tl元素位于第五周期IIIA族 D.Tl(OH)3和Al(OH)3相似,也是两性氢氧化物
|
|
| 10. | 详细信息 |
|
右图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数等于B的质量数,B元素的原子核内质子数等于中子数,下列叙述正确的是( )
A.最高价氯化物对应水化物的酸性C>B B.C的单质是氧化性最强的非金属单质 C.A的氢化物不可能含有非极性键 D.B位于周期表的第三周期VIIA族
|
|
| 11. | 详细信息 |
|
有A、B两种主族元素,原子半径是:r(A)<r(B),且A、B两种元素原子的最外层电子 数相同(选项中的m、n均为正整数),下列说法正确的是( ) A.若B(OH)m是强碱,则A(OH)m一定为强碱 B.若HnAOm是强酸,则B的最高价氧化物对应的水化物一定为强酸 C.若B是金属,则A可能是非金属;若B是非金属,则A可能是金属 D.常温下,若B元素的氢化物是气体,则A元素的氢化物可能是液体
|
|
| 12. | 详细信息 |
|
A、B、C、D、E是核电荷数递增的5种短周期元素,原子半径按D、E、B、C、A递减,B、E同主族,则下列推断正确的是( ) A.A、B、E-定处于三个不同的短周期 B.A、D不可能在同一主族 C.C的最高价氧化物对应的水化物可能显碱性 D.C和D的单质不可能化合成1:1型离子化合物
|
|
| 13. | 详细信息 |
|
短周期元素X、Y、Z的原子序数依次增大,Y为IA族元素,X与Z同主族,3种元素原子的最外层电子数之和为13,下列判断正确的是( ) A.Y与X、Y与Z形成的化合物都只含离子键 B.气态氢化物的热稳定性X<Z C.单质X的熔点比单质Z高 D.简单离子的还原性X<Z
|
|
| 14. | 详细信息 |
|
右图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )
A.X与M形成的一个阴离子中含有29个电子 B.气态氢化物沸点Y>R C.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 D.Z单质能从M与R元素构成的盐溶液中置换出单质M
|
|
| 15. | 详细信息 |
|
X、Y、Z和W代表原子序数依次增大的四种短周期元素,X的一种常见核素原子核内没有中子,在周期表中,Z与Y、W均相邻;Y、Z和W三种元素的原子最外层电子数之和为17。则下列有关叙述正确的是( ) A.Y、Z和W三种元素可能位于同一周期 B.Y和W所形成的含氧酸均为强酸 C.X、Y、Z和W可以X5YZ4W的离子化合物 D.上述元素形成的简单氢化物中,W的氢化物相对分子质量最大,Y的氢化物最稳定
|
|
| 16. | 详细信息 |
|
己知短周期元素的四种离子:aA3+、bB+、。C2-、dD-都具有相同的电子层结构,则下列叙述中正确的是( ) A.原子序数d>c>b>a B.单质的还原性D<C<B<A C.离子半径C2->D->B+>A3+ D.离子的氧化性A3+<B+
|
|
| 17. | 详细信息 | |||||||||||||||||||||||||||
|
a、b、c、d、e、f、g、h为8种由短周期元素构成的微粒,它们都含有10个电子,其结构特点如下:
其中b的离子半径大于e的离子半径,d是由极性键构成的四原予极性分子;c与f可形成两个共价型g分子,h是5原子分子。下列说法不正确的是( ) A.d的水溶液显碱性 B.b对应最高价氧化物对应水化物的碱性比e强 C.h具有可燃性 D.e相应的元素的单质与g微粒在加热条件下也不能反应
|
||||||||||||||||||||||||||||
| 18. | 详细信息 |
|
X、Y、Z、W、R属于短周期元素,其原子序数依次增大,且它们都不是稀有气体元素。X是周期表中原子半径最小的元素,Y是地壳中含量最多的元素,Z、W、R处于同一周期, R与Y处于同一主族,Z、W原子的核外电子数之和与Y、R原予的核外电子数之和相等。下列说法正确的是( ) A.元素Y、Z、W的简单离子具有相同的核外电子层结构,其离子半径依次增大 B.元素X与R形成的双核阴离子能和X、Y形成的双核阴离子反应生成淡黄色沉淀 C.元素Y、R形成的化合物可能具有漂白性 D.常温下,元素W的单质能与R最高偷氧化物对应水化物的浓溶液剧烈反应
|
|
| 19. | 详细信息 |
|
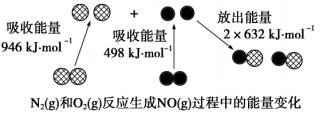
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。右图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
下列说法正确的是( ) A.1 mol N2(g)和1 mol O2(g)完全反应放出的能量为180 kJ B.2 mol N2(g)和2 mol O2(g)具有的总能量小于4 mol NO(g)具有的总能量 C.断开1 mol O=O键需要吸收946 kJ的能量 D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
|
|
| 20. | 详细信息 |
|
己知X、Y、Z都是短周期元素,它们的原子半径依次递增,X原子的电子层数与它的核外电子总数相同,而Z的常见单质的密度是X单质的16倍(相同状况下),Y和Z可以形成两种以上的气态化合物,则下列说法错误的是( ) A.Y和Z可以组成一种Y和Z的质量比为7:20的化合物 B.X、Y、Z组成的一种离子化合物中,X、Y、Z元素原予的个数比可能为4:2:3 C.X和Z可形成X2Z和X2Z2型化合物,所含共价键类型不完全相同 D.由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒只有两种
|
|
| 21. | 详细信息 |
|
二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子中每个原子均满足8电子稳定结构。己知S2Cl2易与水反应,产生能使品红褪色的气体。下列说法中错误的是( ) A.S2Cl2的结构式为Cl-S-S-Cl B.S2Cl2分子中含有极性链和非极性键 C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2<S2Cl2 D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+ 2H2O=SO2↑+ 3S↓+ 4HC1
|
|
| 22. | 详细信息 |
|
A、B是元素周期表中同周期的两种主族元素,它们可以形成离子化合物AmBn,且离子均达到稀有气体原子的电子层结构。若A的原子序数为a,则B的原子序数可能是 ( ) A.a+8+m-n B.a+16-m+n C.a+24-m-n D.a+18-m-n
|
|
| 23. | 详细信息 |
|
(1)H、D、T三种原子,它们之间的关系是_________;在标准状况下,它们的单质的密度之比为_____;1 mol各单质中,它们的质子数之比为________;在标准状况下,1L各种单质中,它们的电子数之比为________。 (2)第116号元素(元素符号Lv)被中国科学技术名词审定委员会命名为垃,该元素在元素周期表中的位置是_____,属于______元素(填“金属”或“非金属”),若该元素存在最高价氧化物对应的水化物,则其化学式为_______。 (3)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。请把与下面元素有关性质相符的曲线标号(A~G)填入相应的空格中:
①IIA族元素的价电子数__________;②第三周期元素的最高正化合价____________; ③VIIA族元素氢化物的沸点____________。 (4)核内中子数为N的R2+,质量数为A,则ng它的相同价态氧化物中所含的电子的物质的量约为_____mol。 ①若R为钙元素,且N=19,则采用原子符号的表达方式,可将R2+表示为_______; ②若R为第五周期IIA元素,则其硫酸盐______于水(填“溶”或“不溶”)。
|
|
| 24. | 详细信息 |
|
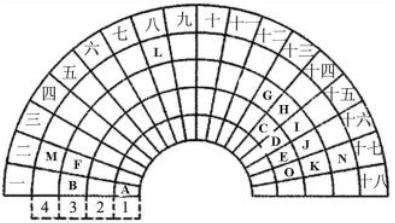
元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题:
(1)L元素在常见周期表中所处的位置是________,其单质与A2E反应的化学方程式为____________。 (2)元素F、G、J、K、M对应简单离子的离子半径由大到小的顺序是(用离子符号表示)___________。 (3)用电子式表示MO2的形成过程:_______________。 (4)B、F、G三种元素最高价氧化物对应的水化物碱性最强的是__________(填化学式)。比较元素C和J的非金属性强弱:C______J(填“强于”或“弱于”)。 (5)向元素B和N形成的化合物的水溶液中,加入元素K的单质,所发生的反应的离子方程式为_____;反应后,向溶液中加入C、K形成的化合物,现象为___________。 (6)均由A、B、E、J四种元素组成的两种化合物可相互反应,写出反应的化学方程式______________。
|
|
| 25. | 详细信息 |
|
现有A、B、C、D、E、F、G七种元素,其中A、B、C、D、E、F为短周期元素且原子序数依次增大;A的最高正价与最低负价的代数和为零;B的最高价氧化物与C的氢化物在水中反应得到的生成物X既可与酸反应又可与碱反应;标准状况下,D2气体的密度约是1.43 g/L;E原子半径在同周期中除稀有气体外最大,F原子M层上的电子比K层多5个。金属G的合金在生活中用量最大,用途最广。 (1)画出元素F形成的简单离子结构示意图_______; (2)若X为正盐,则其中所含的化学键类型有_______________;若X为酸式盐,则它与足量E的最高价氧化物对应水化物的稀溶液反应的离子方程式为_________________; (3)以下三种说法中,可以验证B和F原子得电子能力强弱的是______________(填写编号) a.比较这两种元素的常见单质的沸点 b.二者形成的化合物中,F元素的原子显负价 c.比较这两种元素的气态氢化物的稳定性 (4)向A和F形成的化合物的水溶液中加入少量G单质,反应后,再向溶液申加入A与D形成的化合物,发现溶液颜色变黄,请用离子方程式解释溶液变黄的原因____________。 (5)元素A和C的常见单质都是重要的化工原料,可发生反应:C2(g)+ 3A2 (g) ①用电子式表示C2的形成过程________________。 ②己知常温下拆开1 molA-A键、1 molA-C键、1mol
|
|
| 26. | 详细信息 |
|
现有A、B、C、D、E、F六种短周期元素,其中B,C、D、E四种元素在化学反应中均能形成简单的阴、阳离子,且B、C、D离子具有相同的电子层结构。已知: ①A是形成物质种类最多的元素,F和A同主族; ②C的氢化物分子G是具有10电子的微粒,且可以发生下图转化:
③E和D是同主族元素; ④B和D可形成个数比为1:1和2:1的离子化合物X和Y。 请回答下列问题: (1)B与D形成离子化合物Y具有漂白性,写出Y的电子式______,该化合物和元素A的最高价氧化物O反应的化学方程式为:__________;一定量的Y与O反应后得到的固体物质,能恰好与含400 mL 2 mol/L的稀盐酸反应,并收集到0.25 mol气体,则该固体物质的组成为________(用物质的量表示)。 (2)G气体的检验方法为_________;13.44 L气体G(标准状况下测定)按照上图转化方式可以获得M物质的量分别为__________mol。 (3)某化学兴趣小组欲采用右图装置证明A、C、F三种元素性质的递变性,其中甲装置中锥形瓶内所加试剂为石灰石:
①甲装置中发生反应的离子方程式为________________; ②乙装置中应添加的试剂为______________; ③丙装置中可能发生的实验现象为___________________________。
|
|
| 27. | 详细信息 |
|
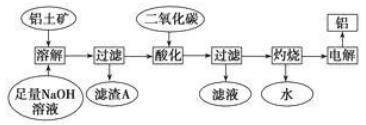
铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是工业上从铝土矿(主要成分是Al2O3,含有少量SiO2、Fe2O3等杂质)中生产铝的工艺流程:
据此回答下列问题: (1)电解制取铝的化学反应中,反应物的键能之和_____生成物的键能之和(填“大于”、“小于”或“等于”)。 (2)铝土矿中绝大部分成分都可以溶解在NaOH溶液中。请根据周期表对角线规则写出铍的氧化物与NaOH溶液反应的离子方程式:______________。 (3)滤渣A的主要成分____________。 (4)在工艺流程第三步中,通入过量二氧化碳所发生反应的化学方程式_______________。 (5)某同学在实验室模拟工业生产铝,称取ag铝土矿可制得bgAl(儇设每步反应进行完全),则铝土矿中Al2O3的质量分数为____________。
|
|