高中化学2020年年末周练知识点——物质的量训练题(1)【含详解】
| 1. | 详细信息 |
|
在光照的条件下,将1 molCH4与一定量的氯气充分混合,经过一段时间,甲烷和氯气均无剩余,生成CH3Cl、CH2Cl2、CHCl3、CCl4和HCl,若已知生成的二氯甲烷、三氯甲烷、四氯化碳的物质的量分别为X mol,Y mol,Z mol,该反应中生成HCl的物质的量是 A.(1+X+2Y+3Z) mol B.(X+Y+Z)mol C.(2X+3Y+4Z)mol D.(1-X-Y-Z)mol
|
|
| 2. | 详细信息 |
|
下列关于物质的量的表述中不正确的是 A.1.5 mol H2O和2.5 mol水 B.2 mol H2SO4和5 mol硫酸 C.1.2 mol H2和1.6 mol氢 D.10 mol Ne和12 mol氖原子
|
|
| 3. | 详细信息 |
|
下列叙述正确的是() A.NaCl的摩尔质量是58.5g B.64g氧气中含有2mol氧 C.4g氦气中含有2mol氦原子 D.0.1molCO2中含有6.02×1022个CO2分子
|
|
| 4. | 详细信息 |
|
下列叙述错误的是( ) ①摩尔是国际单位制中七个基本物理量之一; ②1 mol任何物质都含有约6.02×1023个原子;③6.02×1023就是阿伏加德罗常数;④氢原子的摩尔质量是1 g;⑤HCl的摩尔质量等于1 mol HCl分子的质量;⑥1 mol CO2中含有1 mol碳和2 mol氧。 A.①②③ B.②③④ C.②③④⑥ D.全部
|
|
| 5. | 详细信息 |
|
下列有关物理量相应的单位表达错误的是 A.摩尔质量g/mol B.气体摩尔体积mol/L C.阿伏伽德罗常数mol-1 D.密度g/cm3
|
|
| 6. | 详细信息 |
|
下列说法正确的是 ( ) A.物质的量是物质粒子的数量的简称 B.摩尔是用来描述物质所含微粒数目多少的基本物理量 C.我们把含有6.02×1023个粒子的任何粒子的集合体计量为1摩尔 D.1 mol H2中含2 mol电子
|
|
| 7. | 详细信息 |
|
NA代表阿伏加德罗常数,下列说法正确的是( ) A.在常温常压下,28 g N2与CO混合物气体中所含的分子数目一定为NA B.标准状况下,17 g氨气所含原子数目为NA C.在常温常压下,11.2 L氮气所含的原子数目为NA D.NA个氢分子所占有的体积一定为22.4 L
|
|
| 8. | 详细信息 |
|
1 mol CO和1 mol CO2具有相同的( ) ①分子数 ②原子数 ③C原子数 ④O原子数 A.②④ B.①③ C.①④ D.①②
|
|
| 9. | 详细信息 |
|
下列说法正确的是 ( ) A.摩尔是表示物质的量的单位,每摩尔物质含有6.02×1023个分子 B.2H既可表示2个氢原子,又可表示2 mol氢原子 C.相同物质的量的CO和CO2所含的原子总数目之比为2∶3 D.相同质量的CO和CO2所含的原子总数目之比为1∶1
|
|
| 10. | 详细信息 |
|
下列叙述错误的个数是( ) ①摩尔是国际单位制中七个基本物理量之一 ②1 mol任何物质都含有约6.02×1023个分子 ③6.02×1023就是阿伏加德罗常数 ④1mol水分子中含有2mol氢分子和1 mol氧原子 ⑤H2O的摩尔质量为18g A.2 B.3 C.4 D.5
|
|
| 11. | 详细信息 |
|
下列叙述正确的是 A.6.02×1023叫做阿伏加德罗常数 B.摩尔(mol)是国际单位制中七个基本单位之一 C.H2SO4的摩尔质量(M)是98 D.气体摩尔体积(Vm)是指1 mol任何气体所占的体积都约为22.4 L
|
|
| 12. | 详细信息 |
|
下列说法不正确的是 A.1 mol NH4+的质量为18 g B.SO2的摩尔质量为64 g·mol-1 C.摩尔是描述物质所含微粒多少的物理量 D.一个水分子的质量约等于18/(6.02×1023 )g
|
|
| 13. | 详细信息 |
|
下列说法正确的是( ) A.摩尔是一个基本物理量 B.1mol H2O中所含氧原子的质量为16g C.10L氢气比8L氢气所含H2的物质的量多 D.某物质含有6.02×1023个粒子,则该物质的体积为22.4L
|
|
| 14. | 详细信息 |
|
下列对于“摩尔”的理解正确的是 A.摩尔是国际科学界建议采用的一种物理量 B.摩尔是物质的量的单位,简称摩,符号为mol C.1mol氧气含1mol氧原子 D.1mol氢含6.02×1023个H2
|
|
| 15. | 详细信息 |
|
下列说法正确的是 A.摩尔既是物质的量的单位,又是粒子的数量单位 B.2 mol O2的摩尔质量是64 g/mol C.当摩尔质量以g·mol-1为单位时,在数值上与阿伏加德罗常数个该物质的微粒的质量总和相等(质量以g为单位) D.1 mol SO2中含有2 mol氧元素
|
|
| 16. | 详细信息 |
|
下列叙述正确的是 A.1 mol H2O的质量为18 g/mol B.CH4的摩尔质量为16 g C.3.01×1023个SO2分子的质量为32g D.标准状况下,1 mol任何物质体积均为22.4 L
|
|
| 17. | 详细信息 |
|
某氧原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中正确的是( ) ①该氧原子的相对原子质量为12a/b ②m g该氧原子的物质的量为m/(aNA) mol ③该氧原子的摩尔质量是aNA g ④a g该氧原子所含的电子数为8 mol A.①③ B.②④ C.①② D.②③
|
|
| 18. | 详细信息 |
|
下列叙述中,错误的是 A.阿伏加德罗常数的符号为NA,其近似值为6.02×1023 mol-1 B.等物质的量的O2与O3,所含氧原子数相同 C.在0.5 mol Na2SO4中,含有的Na+数约是6.02×1023 D.摩尔是物质的量的单位
|
|
| 19. | 详细信息 |
|
下列各组物理量中,随取水量的变化而变化的是( ) A.水的密度 B.水的沸点 C.水的物质的量 D.水的摩尔质量
|
|
| 20. | 详细信息 |
|
下列叙述中正确的是 A.1mol任何纯净物都含有相同的原子数 B.1mol O2中约含有6.02×1023个氧气分子 C.1mol氢中含有2mol氢原子 D.阿伏加德罗常数就是6.02×1023
|
|
| 21. | 详细信息 |
|
下列各物质所含原子数目,按由大到小顺序排列的是( ) ①0.5 mol NH3②标准状况下22.4 L He ③4 ℃ 9 mL水 ④19.6 g H3PO4 A.①④③② B.④③②① C.②③④① D.①④②③
|
|
| 22. | 详细信息 |
|
下列说法中正确的是( ) A.摩尔既是物质的数量单位又是物质的质量单位 B.阿伏加德罗常数是12 kg 12C中含有的碳原子数 C.1 mol水分子中含有2 mol氢原子和1 mol氧原子 D.一个NO分子的质量是a g,一个NO2分子的质量是b g,则氧原子的摩尔质量是(b-a) g·mol-1
|
|
| 23. | 详细信息 |
|
光纤通讯是一种现代化的通讯手段,光纤通讯容量大,一对光纤上可同时传送3万门电话的信号。制造光导纤维的主要原料是SiO2,下列关于SiO2的说法正确的是( ) A.SiO2摩尔质量是60 B.1 mol SiO2中含有1 mol O2 C.1.5mol SiO2中含有1.806×1024个氧原子 D.1 mol SiO2质量是60 g mol-1
|
|
| 24. | 详细信息 |
|
下列有关叙述说法错误的是 A.物质的量的描述对象是宏观物体 B.当质量的单位以g为单位时,铁的摩尔质量在数值上等于它的相对原子质量 C.阿伏加德罗常数是指0.012kg 12C所含的碳原子数,其数值约等于6.02×1023 D.标准状况下,2mol气体的体积约为44.8L
|
|
| 25. | 详细信息 |
|
下列说法中,正确的是( ) A.1 mol氢约含有阿伏加德罗常数个氢 B.1 mol CaCl2含有1 mol Cl- C.1 mol电子约含有6.02×1023个电子 D.1 mol H2O含有1 mol H2和1 mol O
|
|
| 26. | 详细信息 |
|
下列关于“物质的量”、“摩尔”和“摩尔质量”的叙述中正确的是 A.物质的摩尔质量等于其相对分子(原子)质量 B.“物质的量”是国际单位制中的一个基本单位 C.0.012 kg12C中所含的碳原子数为NA D.1mol任何物质都含有约6.02×1023个原子
|
|
| 27. | 详细信息 |
|
物质的量的单位是( ) A.千克 B.升 C.秒 D.摩尔
|
|
| 28. | 详细信息 |
|
下列叙述中,正确的是 A.H2SO4的摩尔质量是98 B.等质量的O2和O3中所含的氧原子数相同 C.等质量的CO与CO2中所含碳原子数之比为7︰11 D.98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L
|
|
| 29. | 详细信息 |
|
将下列溶液分别稀释到100 mL,稀释后的溶液中氯离子浓度最大的是 A.15 mL 1 mol•L﹣1的AlCl3 B.50 mL 1 mol•L﹣1的KCl C.20 mL 2 mol•L﹣1的NH4Cl D.10 mL 2 mol•L﹣1的CaCl2
|
|
| 30. | 详细信息 |
|
欲配制100mL1.0 mol/L Na2SO4溶液,正确的方法是( ) ①将14.2 g Na2SO4,溶于100mL水中 ②将32.2g Na2SO4•10H2O溶于少量水中,再用水稀释至100 mL ③将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL A.①② B.②③ C.①③ D.①②③
|
|
| 31. | 详细信息 |
|
下列说法中正确的是( ) A.1L水中溶解了 58.5g NaCl,该溶液中溶质的物质的量浓度为1mol•L-1 B.配制500mL 0.5mol•L-1的CuSO4溶液,需62.5g胆矾 C.从1L2mol•L-1的H2SO4溶液中取出0.5L,该溶液的浓度为1mol•L-1 D.中和100 mL1mol•L-1的 H2SO4溶液,需 NaOH 4g
|
|
| 32. | 详细信息 |
|
小张最近去医院做了体检,得到的血液化验单中标有葡萄糖 A.溶解度 C.质量分数
|
|
| 33. | 详细信息 |
|
下列关于物质的量浓度表述正确的是 A.0.3 mol·L-1的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9 mol B.当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol·L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol·L-1 C.在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 D.10 ℃时,100 mL 0.35 mol·L-1的KCl饱和溶液蒸发掉5 g水,冷却到10 ℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol·L-1
|
|
| 34. | 详细信息 |
|
与100mL 0.1mol/LNa2CO3溶液中Na+离子浓度相同的是 A.50mL 0.2mol/LNaCl溶液 B.10mL1mol/LNa2SO4溶液 C.200mL0.1mol/LNaNO3溶液 D.10mL0.2mol/LNa2SO4溶液
|
|
| 35. | 详细信息 |
|
下列溶液中溶质的物质的量浓度为1 mol·L-1的是 A.将58.5 g NaCl溶解于1 L水中配成的溶液 B.将80 g SO3溶于水并配成1 L溶液 C.将0.5 mol·L-1的NaNO3溶液100 mL加热蒸发掉50 g水的溶液 D.含K+为2 mol的K2SO4溶液
|
|
| 36. | 详细信息 |
|
下列溶液中,跟100mL 0.6mol/L NaCl溶液所含的Cl-物质的量浓度相同的是(以下混合溶液的总体积近似看作各溶液体积之和) ( ) A.50mL 0.6mol/L MgCl2溶液 B.200mL 0.3mol/L AlCl3溶液与100mL 0.2mol/L AgNO3溶液的的混合溶液 C.70ml 1mol/L NaCl溶液与100ml 1mol/L KCl溶液的混合溶液 D.25ml 0.6mol/L HCl溶液 与50mL 0.3mol/L MgCl2溶液的混合溶液
|
|
| 37. | 详细信息 |
|
在物质的量浓度公式c= A.溶液的物质的量 B.溶质的物质的量 C.溶剂的物质的量 D.物质的量
|
|
| 38. | 详细信息 |
|
标准状况下,V L NH3 溶解在1 L水中(水的密度近似为1g/mL),所得溶液密度为ρg/mL,溶质质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是 ( ) A.ω= C.c=
|
|
| 39. | 详细信息 |
|
下列关于物质的量浓度表述正确的是( ) A.0.3 mol·L-1的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9 mol B.50mL 1mol·L-1的KCl溶液和100mL 0.25 mol·L-1MgCl2溶液中,Cl-物质的量浓度相等 C.将10 mL 1 mol·L-1的H2SO4稀释成0.1 mol·L-1的H2SO4,可向其中加入100 mL水 D.20℃时,0.023 mol·L-1的氢氧化钙饱和溶液100mL加入5g生石灰,冷却到 20℃时,其体积小于 100mL,它的物质的量浓度仍为0.023 mol·L-1
|
|
| 40. | 详细信息 |
|
下列关于物质的量浓度表述正确的是 A.0.3 mol·L-1的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9 mol B.在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 C.当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol·L-1,只有当22.4 L(标准状况)氨气溶于水制得1 L氨水时,其浓度才是1 mol·L-1 D.10 ℃时,100 mL 0.35 mol·L-1的KCl饱和溶液蒸发掉5 g水,冷却到10 ℃时,其体积小于100 mL,它的物质的量浓度大于0.35 mol·L-1
|
|
| 41. | 详细信息 |
|
下列关于物质的量浓度表述正确的是 A.0.3mol·L-1Na2SO4溶液中含有Na+和SO42—总物质的量为0.9mol B.10℃时0.35mol·L-1的KCl饱和溶液100mL,蒸发掉5 g水,再冷却到10℃时,它的物质的量浓度仍为0.35mol·L-1 C.用1L水吸收标准状况下22.4 L氨气所得氨水的浓度是1mol·L-1 D.50mL 1mol·L-1的KCl溶液和100mL 0.25 mol·L-1MgCl2溶液中,Cl-物质的量浓度相等
|
|
| 42. | 详细信息 |
|
下列所得溶液的物质的量浓度为0.1mol/L的是( ) A.将0.1mol氨充分溶解在1L水中 B.将10g质量分数为98%的硫酸与990g水混合 C.将25.0g胆矾溶于水配成1L溶液 D.将10mL1mol/L的盐酸与90mL水充分混合
|
|
| 43. | 详细信息 |
|
阿伏加德罗常数的值为NA,下列说法正确的是 A.标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA B.1mol Na2O2与足量CO2充分反应,转移的电子数为2 NA C.25℃1LpH=12的Na2CO3溶液中,由水电离出H+的数目为0.01NA D.0.1 mol H2和0.1 molI2于密闭容器中充分反应后,HI分子总数为0.2NA
|
|
| 44. | 详细信息 |
|
下列叙述正确的是 A.1 mol N2的质量为28 g/mol B.标准状况下,1 mol任何物质的体积均为22.4 L C.Cl2的摩尔质量为71 g D.3.01×1023个SO2 分子的质量为32 g
|
|
| 45. | 详细信息 |
|
下列说法不正确的是 A.同温、同压下,相同质量的气体都占有相同的体积 B.同温、同压下,相同体积的气体都含有相同数目的分子 C.1 mol O2中含有1.204×1024个氧原子,在标准状况下占有体积22.4 L D.由0.2 g H2和8.8 g CO2、5.6 g CO组成混合气体,其密度是相同状况下O2密度的0.913倍
|
|
| 46. | 详细信息 |
|
用NA表示阿伏加德罗常数的值。下列叙述正确的是 ①31g白磷中含有1.5NA个P-P键 ②1L0.1mol·L-1的Na2CO3溶液中所含阴离子的总数目为0.1NA ③标准状况下,22.4LHF中含有NA个分子 ④电解精炼铜时,若转移NA个电子,则阳极溶解32g铜 ⑤将2.24L(标准状况)Cl2溶于水,转移的电子数为0.1NA ⑥常温下,含有0.2molH2SO4的浓硫酸与足量铜反应,生成SO2分子的数目小于0.1NA ⑦142gNa2SO4和Na2HPO4的固体混合物中所含阴、阳离子的总数目为3NA ⑧NA个Fe(OH)3胶体粒子的质量为107g A.①③④ B.①⑥⑦ C.③⑤⑦ D.①⑥⑧
|
|
| 47. | 详细信息 |
|
利用太阳能分解制氢,若光解0.02 mol水,下列说法正确的是( ) A.可生成H2的质量为0.02g B.可生成氢的原子数为2.408×1023个 C.可生成H2的体积为0.224L(标准状况) D.生成H2的量理论上等于0.04mol Na与水反应产生H2的量
|
|
| 48. | 详细信息 |
|
下列说法正确的是 A.同温同压下甲烷和氧气的密度之比为2∶1 B.1 g甲烷和1 g氧气的原子数之比为5∶1 C.等物质的量的甲烷和氧气的质量之比为2∶1 D.在标准状况下等质量的甲烷和氧气的体积之比为1∶2
|
|
| 49. | 详细信息 |
|
将26.4 g Na2O与Na2O2的混合物投入足量的水中溶解,反应后水溶液增重24.8 g,则原混合物Na2O与Na2O2的物质的量之比是 A.1:3 B.3:1 C.13:31 D.31:13
|
|
| 50. | 详细信息 |
|
用0.2mol·L-1某金属阳离子Rn+的盐溶液40mL,恰好将20mL0.4mol·L-1的硫酸盐中的硫酸根离子完全沉淀,则n值为( ) A.1 B.2 C.3 D.4
|
|
| 51. | 详细信息 |
|
某工业废气所含氮氧化物(NxOy)的氮氧质量比为7∶4,该NxOy可表示为 A.N2O B.NO C.N2O3 D.NO2
|
|
| 52. | 详细信息 |
|
设NA表示阿伏加德罗常数的值,下列叙述中正确的是 A.常温常压下,11.2 L氧气所含的氧原子数为NA B.1.8 g NH4+中含有的电子数为NA C.含有NA个氖原子的氖气在标准状况下的体积约为11.2 L D.0.5 L 0.2 mol/L的Na2SO4溶液中含有Na+ 0.1NA
|
|
| 53. | 详细信息 |
|
将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol·L-1 NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是( ) A.加入合金的质量不可能为6.4 g B.参加反应的硝酸的物质的量为0.1 mol C.沉淀完全时消耗NaOH溶液的体积为150 mL D.溶解合金时收集到NO气体的体积在标准状况下为2.24 L
|
|
| 54. | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的是 A.1L0.5mol·L-1葡萄糖溶液中O-H键数目为2.5NA B.5.6g铁与硝酸完全反应时转移的电子数目可能为0.25NA C.0.lmol苯与足量氢气反应后,破坏碳碳双键的数目为0.3NA D.10 g KHCO3和CaCO3的固体混合物中含有的CO32-数目为0.1NA
|
|
| 55. | 详细信息 |
|
质量相同的下列物质,含分子数最少的是 A.氢气 B.氧气 C.氮气 D.二氧化碳
|
|
| 56. | 详细信息 |
|
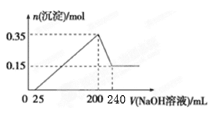
向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1 mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是
A.图中C点铝元素存在形式是 B.向D点溶液中通入CO2气体,立即产生白色沉淀 C.原混合液中 D.OA段反应的离子方程式为:3Ba2++2Al3++8OH−+3
|
|
| 57. | 详细信息 |
|
NA为阿伏伽德罗常数的值,下列叙述正确的是( ) A.1.0L1.0mo1·L-1的NaAlO2水溶液中含有的氧原子数为2NA B.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA C.25℃时pH=13的NaOH溶液中含有OH-的数目为0.1 NA D.1 mol的羟基与1 moL的氢氧根离子所含电子数均为9 NA
|
|
| 58. | 详细信息 |
|
VL硫酸钾溶液中含有mg钾离子,则溶液中硫酸根离子的物质的量浓度 A.
|
|
| 59. | 详细信息 |
|
NA表示阿伏加德罗常数的值,下列关于0.2 mol·L-1 K2SO4溶液的说法正确的是( ) A.1 000 mL溶液中所含K+、SO42-总数为0.3NA B.500 mL溶液中有0.1NA个K+ C.1 L溶液中K+的浓度为0.4 mol·L-1 D.1 L溶液中SO42-的浓度是0.4 mol·L-1
|
|
| 60. | 详细信息 |
|
NA代表阿伏加德罗常数的值。下列说法正确的是( ) A.向1L0.5mol/L盐酸溶液中通入NH3至中性(忽略溶液体积变化),此时NH4+个数为0.5NA B.向含有FeI2的溶液中通入适量氯气,当有1 mol Fe2+被氧化时,该反应中转移电子数目为3NA C.标准状况下,22.4L二氯甲烷中含有4NA极性共价键 D.用惰性电极电解CuSO4溶液,标况下,当阴极生成22.4L气体时,转移的电子数为2NA
|
|
| 61. | 详细信息 |
|
设NA为阿伏加德罗常数的值。下列说法正确的是 A.25℃,101kPa条件下,5.6L甲烷和乙烯的混合气体中含氢原子数为NA B.将4.6g钠用铝箔包裹并刺小孔,与足量水充分反应生成H2分子数为0.1NA C.将1mol Cl2通入到足量的水中,则N(HClO)+N(Cl−)+N(ClO−)=2NA(N表示粒子数) D.50℃时,1L pH=1的H2SO4溶液中,含有H+的数目为0.1NA
|
|
| 62. | 详细信息 |
|
NA是阿伏加德罗常数的值,下列说法错误的是 A.12.5mL 16mol/L浓硫酸与足量锌充分反应,转移电子数为0.2NA B.5.8g熟石膏(2CaSO4 • H2O)含有的结晶水分子数为0.02NA C.92.0g甘油(丙三醇)和甲苯的混合物中含氢原子数为8.0NA D.标准状况下,1L甲醛气体完全燃烧消耗O2分子个数约为
|
|
| 63. | 详细信息 |
|
同温同压下,等质量的SO2气体和SO3气体相比较,下列叙述中正确的是( ) A.密度比为4:5 B.物质的量之比为4:5 C.体积比为1:1 D.原子数之比为3:4
|
|
| 64. | 详细信息 |
|
设NA表示阿伏伽德罗常数,下列说法正确的是( ) A.标况下,11.2L氟化氢中含有的电子数5NA B.6.0g甲醛(HCHO)和醋酸的混合物中含有的原子总数为0.8NA C.100mL 0.1mol/L 的KAl(SO4)2溶液中含有的阳离子总数为0.02NA D.分别由H2O2和KMnO4制备等量的氧气转移的电子数目相等
|
|
| 65. | 详细信息 |
|
相同物质的量的钠、镁、铝与过量的稀硫酸反应,在标况下产生氢气的体积比是( ) A.1:1:1 B.1:2:3 C.6:3:2 D.23:24:27
|
|
| 66. | 详细信息 |
|
一定量的锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6L(标况)。将反应液稀释至1 L,测得溶液的c(H+)=0.1mo1·L-1,则叙述中错误的是 ( ) A.气体A为SO2和H2的混合物 B.气体A中SO2与H2的体积之比为4︰1 C.反应中共消耗97.5g Zn D.反应中共转移3 mol电子
|
|
| 67. | 详细信息 |
|
设NA阿伏加德罗常数的值,下列说法不正确的是 A.10g的2H216O含有的质子数与中子数均为5NA B.32g硫在足量的氧气中充分燃烧,转移电子数为6NA C.26gC2H2与C6H6混合气体中含C—H键的数目为2NA D.120gNaHSO4和KHSO3的固体混合物中含有的阳离子数为NA
|
|
| 68. | 详细信息 |
|
标准状况下,质量相等的下列物质中体积最大的是 A.N2 B.Cl2 C.H2 D.CO2
|
|
| 69. | 详细信息 |
|
标准状况下有①6.72LCH4;②3.01x1023个HCl;③13.6gH2S;④0.2molNH3。下列对四种气体的关系从小到大表示不正确的是( ) A.体积:④<①<②<③ B.密度:①<④<③<② C.质量:④<①<③<② D.氢原子数:②<④<③<①
|
|
| 70. | 详细信息 |
|
1 mol MgCl2中含有 ( ) A.3.01×1023个Mg2+ B.6.02×1023个Cl- C.1 mol Mg2+ D.1 mol Cl2
|
|
| 71. | 详细信息 |
|
设NA为阿伏加德罗常数的值.下列说法正确的是( ) A.1L 1mol•L ﹣1的NaClO溶液中含有ClO﹣的数目为NA B.78g 苯含有C=C双键的数目为3NA C.常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA D.标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA
|
|
| 72. | 详细信息 |
|
下列物质中,其物质的量为0.2mol的是 A.2.2g CO2 B.4.8gMg C.4.48L O2 D.49g H2SO4
|
|
| 73. | 详细信息 |
|
下列叙述正确的是( ) A.一定温度、压强下,气体体积由其分子的大小决定 B.一定温度、压强下,气体体积由其物质的量的多少决定 C.气体摩尔体积是指1mol任何气体所占的体积为22.4L D.不同的气体,若体积不等,则它们所含的分子数一定不等
|
|
| 74. | 详细信息 |
|
下列碳原子的物质的量为1 mol的是( ) A.0.012 kg C B.0.012 kg12C C.0.012 kg13C D.0.012 kg12C和13C
|
|
| 75. | 详细信息 |
|
下列叙述错误的是( ) A.1mol任何物质都含有6.02×1023个原子 B.0.012kg12C 含有阿伏加德罗常数个碳原子 C.在使用摩尔表示物质的量的单位时,应指明粒子的种类 D.物质的量是国际单位制中七个基本物理量之一
|
|
| 76. | 详细信息 |
|
下列叙述正确的是 A.1 mol H2SO4 的质量为98 g·mol−1 B.98 g H2SO4含有NA个H2SO4分子 C.H2SO4的摩尔质量为98 g D.6.02×1023个H2SO4分子的质量为9.8 g
|
|
| 77. | 详细信息 |
|
设NA表示阿伏加德罗常数的数值,下列叙述中正确的是( ) A.物质的量就是指物质的多少 B.24g金属镁变为镁离子时失去的电子数为NA C.常温常压下,48g O3含有的氧原子数为3NA D.同温同压下,NA个NO与NA个N2和O2的混合气体的体积不相等
|
|
| 78. | 详细信息 |
|
下列说法中正确的是( ) A.摩尔是国际科学界建议采用的一种物理量 B.0.012 kg 12C中所含的碳原子数为NA C.物质的摩尔质量等于其相对分子(原子)质量 D.1 mol任何物质都含有约6.02×1023个原子
|
|
| 79. | 详细信息 |
|
在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41 g,CO2的体积为1.344 L(标准状况),则钴氧化物的化学式为 A.Co2O3 B.Co3O4 C.CoO D.CoO3
|
|
| 80. | 详细信息 |
|
用NA表示阿伏加德罗常数的数值,按要求完成下列填空。 (1)1 mol O2中含有____________个氧气分子,含有________个氧原子。 (2)0.5 mol H2O中含有________个水分子,含有________个原子。 (3)6 mol NO和_____mol NO2所含原子数相等,与1 mol CO2所含电子数相等的H2的物质的量是_____mol,6 mol H2O与___mol NH3所含氢原子数相等,1 mol HCl与____mol CH4所含电子数相等。 (4)1个CO2分子含有________个电子,1 mol CO2含有______mol e-,_____个e-。 (5)1个H2O分子含有_______个原子,2 mol H2O含有________mol e-,______个e-。 (6)1.204×1024个水分子的物质的量是_____。1 mol H2SO4中氧原子数为________。 (7)某硫酸钠溶液中含有3.01×1022个Na+,则该溶液中SO (8)1 mol NaCl中氯离子数为________,离子总数为________。
|
|
| 81. | 详细信息 |
|
取50.0 mL Na2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51 g白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66 g,并有气体放出。试计算: (1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度;______________ (2)产生的气体在标准状况下的体积。_______________
|
|
| 82. | 详细信息 |
|
填写下列空白: (1)一定质量的Al2(SO4)3中含有2.7 g Al3+,含有________个SO42-;溶于水得100 mL溶液,所得溶液的物质的量浓度为________ mol·L-1。 (2)同温同压下,同质量的CO2和SO2,它们的密度之比为________,氧原子数之比为________。 (3)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__________。 (4)标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体中,NH3的体积分数为__________,该混合气体对氢气的相对密度为________。 (5)已知ag A和bg B恰好完全反应生成0.2 mol C和dg D,则C的摩尔质量为____________。
|
|
| 83. | 详细信息 |
|
由于镁合金具有硬度大、密度小、散热性好、抗震性好等优异性能它被用于制笔记本电脑外壳、竞赛自行车车架等。现称取一定质量的镁铝合金样品放入500 mL稀硫酸中,固体全部溶解并放出气体。待反应完全后,向所得溶液中加入NaOH 溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。 (1)合金中Al的质量为__________________。 (2)NaOH溶液的物质的量浓度为__________________。 (3)稀硫酸的物质的量浓度为__________________。
|
|
| 84. | 详细信息 |
|
判断正误(正确的打“√”,错误的打“×”) (1)物质的量是衡量物质数量的基本物理量(_______) (2)摩尔是用来描述微观粒子的物理量(_______) (3)摩尔质量实际上就是相对原子质量(_______) (4)两种不同粒子的摩尔质量一定不同(_______) (5)1 mol氧中含有6.02×1023个氧原子(_______) (6)1 mol任何物质都含有6.02×1023个分子(_______)
|
|
| 85. | 详细信息 |
|
⑴1个N2分子的质量约为______; ⑵要使每50个水分子中含1个Na+,则90g水中需要加入NaOH的质量为_____。 ⑶________ molH2SO4分子与1.806×1024个水分子含有相同的氧原子数。 ⑷4.5g水与_____g硫酸所含的分子数相等,它们所含氧原子数之比是_____。
|
|
| 86. | 详细信息 |
|
(1)0.3 mol CH4 含有的电子数目为____;它与____克 CO2 的原子总数相同;O2 与 SO2 等质量混合,该混合物中 O2 与 SO2 的物质的量之比为______。 (2)某常见气体在标准状况下的密度为 1.25 g/L,若该气体的分子式为 A2 型, 则其名称是______。 (3)取 100 mL 1mol/L NaCl 溶液与 300 mL0.5mol/L MgCl2 溶液配成混合溶液,则该混合溶液中 Cl-的物质的量浓度为______。
|
|
| 87. | 详细信息 |
|
(1)已知8 g A能与32 g B恰好完全反应,生成22 g C和一定量的D;现将16 g A与70 g B混合,充分反应后,生成2 mol D和一定量的C,则D的摩尔质量为__________。 (2)标准状况下,0.5molH2和 O2的混合气体所占的体积为________。 (3)8.5 g氢氧根离子含有的电子数目为________。 (4)14 g C2H4与C4H8的混合物所含质子的物质的量为________。
|
|
| 88. | 详细信息 |
|
3mol
|
|
| 89. | 详细信息 |
|
质量相同的SO2和SO3的物质的量之比是___,摩尔质量之比是 _____,含氧原子个数比是__________ 。
|
|
| 90. | 详细信息 |
|
硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)……等,其中硫酸最为重要,在工业上有广泛的应用。试回答以下问题(并写出必要的过程): (1)已知某硫酸溶液的的密度为1.84 g/cm3,质量分数为98%,该硫酸溶液的物质的量浓度为_____mol·L-1。 (2)若将其稀释为500mL 0.2mol/L的溶液,需用量筒取该浓硫酸___________mL (3)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将89 g焦硫酸溶于水配成800 mL硫酸,则该硫酸的物质的量浓度为_____mol·L-1。 (4)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:3FeS2+8 O2=Fe3O4+6SO2,4FeS2+11 O2=2Fe2O3+8SO2,若2.4 mol FeS2完全反应耗用氧气145.6 L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比___________。
|
|
| 91. | 详细信息 |
|
(1)质量之比为16:7:6的三种气体SO2、CO、NO,分子个数之比为________;氧原子个数之比为________;相同条件下的体积之比为________。 (2)标准状况下,1.7 g NH3的体积为________L,它与标准状况下________L H2S含有相同数目的氢原子。 (3)某气体氧化物的化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为______,R的相对原子质量为________。
|
|
| 92. | 详细信息 |
|
(1)相同温度和压强下,等质量的SO2和O2。二者体积比为__________,分子个数比为________,密度比为________。 (2)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是________,CO的体积分数是________,CO的质量分数是________,C和O原子个数比是________,混合气体的平均相对分子质量是________,密度是________g·L−1。
|
|
| 93. | 详细信息 |
|
利用“化学计量在实验中的应用”的相关知识进行填空(设NA表示阿伏加德罗常数的值)。 (1)标准状况下,0.2 mol氨气的体积是__________, 其中含有的NH3分子数是__________,含氢原子数是_______。 (2)H2SO4的摩尔质量是________, 49 g 的H2SO4中含有______mol氧原子,能与______mol NaOH恰好完全反应。 (3)将0.5 mol Na2CO3 溶解在水中,配成500mL溶液,所得溶液中溶质的物质的量浓度是__________
|
|
| 94. | 详细信息 |
|
(1)4.9g H2SO4含__________个H2SO4分子,能和__________mol NaOH完全反应. (2)含有相同碳原子数的CO和CO2,其质量比为____________ (3)在同温同压下,等质量的CO和CO2,其体积之比为____________ (4)标准状况下有①44.8L CH4,②9.03x 1023个NH3分子,③85g H2S三种气体,对这三种气体的物质的量从大到小的顺序是__________. (5)在一定的温度和压强下,1体积气体X2跟3体积气体Y2化合生成2体积化合物,则该化合物的化学式是____________. (6)某盐混合溶液中含有离子:Na+、Mg2+、Cl﹣、SO42﹣,测得Na+、Mg2+和Cl﹣的物质的量浓度依次为:0.2mol•L﹣1、0.25mol•L﹣1、0.4mol•L﹣1,则c(SO42﹣)=_____________.
|
|
| 95. | 详细信息 |
|
填写下列空白: (1)含有6.02×1023个H的H2O,其物质的量是________mol;某硫酸钠溶液中含有3.01×1023个Na+,则溶液中SO42-的物质的量是 ____________mol,该溶液中Na2SO4的质量为 ______________g。 (2)_____________mol H2O中含有的氧原子数与1.5 mol CO2中含有的氧原子数相等。 (3)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为______________。 (4)已知16gA和20gB恰好完全反应生成0.04molC和31.76gD,则C的摩尔质量为 ________。
|
|
| 96. | 详细信息 |
|
(1)6.02×1023个氢氧根离子的物质的量是________mol,其摩尔质量为________。 (2)3.01×1023个H2O的物质的量为________mol,其中所有原子的物质的量为________mol,所含电子的物质的量为________mol。 (3)1.204×1023个NH4+的物质的量为________mol,质量为________g。
|
|
| 97. | 详细信息 |
|
请回答下列问题: (1)同温同压下,同体积的N2和SO2分子数之比为___,物质的量之比为___,原子总数之比为____,摩尔质量之比为___,质量之比为____,密度之比为____。 (2)现有质量比为11:14的CO2和CO的混合气体,则该混合气体中的CO2和CO物质的量之比为____,碳原子和氧原子的个数比为___,该混合气体的摩尔质量为____。 (3)12.4gNa2X中含Na+0.4mol,则Na2X的摩尔质量是___,X的相对原子质量是___。 (4)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2L“人造空气”的质量是4.8g,其中氧气和氦气的分子数之比是___,氧气的质量是___。
|
|
| 98. | 详细信息 |
|
(1)0.5 mol Na2CO3中含有_____个Na+。 (2)等质量的HCl、NH3、CO2、O2四种气体,在相同温度和相同压强条件下,体积最大的是_______。 (3)实验室需要0.50mol·L—1NaCl溶液480mL。 ①配制溶液时必需的仪器有:托盘天平(精确到0.1)、药匙、烧杯、玻璃棒、______、胶头滴管以及等质量的几片滤纸。 ②配制该溶液需称取NaCl晶体的质量为_______。 ③下列操作会使所配溶液浓度偏低的是________。 A 容量瓶洗涤干净后未干燥 B 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水 C 定容时俯视刻度线 D 烧杯和玻璃棒未洗涤
|
|
| 99. | 详细信息 |
|
在同温同压下,对于等质量的SO2和CO2两种气体,求其下列各项比值。 (1)摩尔质量比___________; (2)密度比___________; (3)物质的量比___________; (4)体积比为___________; (5)分子数比___________。
|
|
| 100. | 详细信息 |
|
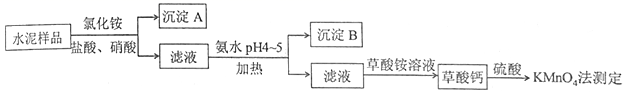
水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
回答下列问题: (1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是________________________________________,还可使用___________代替硝酸。 (2)沉淀A的主要成分是_________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。 (3)加氨水过程中加热的目的是______________________________________。沉淀B的主要成分为_____________、____________(填化学式)。 (4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:MnO4-+H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
|
|