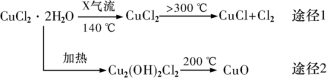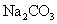高中化学必修一2020-2021学年度——金属材料综合复习题含详解(一)
| 1. | 详细信息 |
|
下列实验中金属或氧化物可以完全溶解的是 A . 1mol Cu 与含 2mol H 2 SO 4 的浓硫酸共热 B . 1mol MnO 2 与含 2mol H 2 O 2 的溶液共热 C . 常温下 1mol Al 投入足量的浓硫酸中 D . 常温下 1mol Cu 投入含 4mol HNO 3 的浓硝酸中 |
|
| 2. | 详细信息 |
|
对下列事实的解释错误的是 A . 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 B . 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 C . 常温下,浓硝酸可以用铝制器皿贮存,说明铝与浓硝酸不反应 D . 将 SO 2 通入 BaCl 2 溶液至饱和,未见沉淀生成,继续通入另一种气体,有白色沉淀,则通入的气体可能是 NH 3 |
|
| 3. | 详细信息 |
|
下列有关化学反应的叙述正确的是 A . 常温下, Mg 在 CO 2 中燃烧生成 MgCO 3 B . 常温下,铁分别与稀盐酸和氯气反应,产物中铁元素的化合价相同 C . 常温下, Al 在氢氧化钠溶液中反应会产生气体 D . 常温下, Ag 在浓硝酸中发生钝化 |
|
| 4. | 详细信息 |
|
中国青铜器在世界上享有极高声誉。所谓青铜是铜与锡或铅等元素按一定比例熔铸而成的,颜色呈青,故名青铜。青铜器在外界环境影响下所形成的腐蚀产物,由内向外为 CuCl 、 Cu 2 O ,再向外是 CuCO 3 · 3Cu ( OH ) 2 或 CuCl 2 · 3Cu ( OH ) 2 ,或两者都有的层叠状结构。下列说法中错误的是 ( ) A. 青铜属于铜的一种合金,具有较高硬度 B . 加入锡或铅可以降低 “熔铸”时所需温度 C . 青铜的主要成分为铜,铜通常呈现青色 D . 青铜器外层的腐蚀物与空气中的氧气有关 |
|
| 5. | 详细信息 |
|
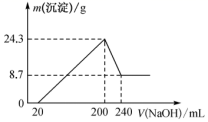
将一定质量的镁铝合金投入一定体积 10 mol · L - 1 的盐酸中,固体全部溶解后,向所得溶液中加入 NaOH 溶液,生成沉淀的质量与加入 NaOH 溶液的体积关系如图所示。若不考虑金属和盐酸反应时 HCl 的挥发,则下列说法不正确的是 A . 该镁铝合金中铝的质量为 5 . 4 g B . 所用 NaOH 物质的量浓度为 4 . 5 mol · L - 1 C . 反应中沉淀的物质的量最多时为 0 . 35 mol D . 溶解合金所用盐酸的体积为 100 mL |
|
| 6. | 详细信息 |
|
将表面已完全氧化的铝条,插入下列溶液中,不会发生反应的是 A . 稀硫酸 B . 稀硝酸 C . 氯化铜 D . 氢氧化钠 |
|
| 7. | 详细信息 |
|
下列有关物质的用途说法正确的是 ( ) A . 氧化镁常用于制造信号弹和焰火 B . 溴可用于生产多种药剂,如杀虫剂、抗爆剂等 C . 铜盐可杀死某些细菌,故常用硫酸铜作自来水消毒剂 D . 碳酸钙可用来调节水泥的硬化速度 |
|
| 8. | 详细信息 |
|
N A 表示阿伏加德罗常数的值,下列说法正确的是 ( ) A . 常温常压下, 11 . 2L 氧气所含的 O 原子数为 N A B . 1mol / L 的 CaCl 2 溶液中含有的 Cl - 为 2N A C . 2 . 4g 镁与足量稀硫酸反应,产生 H 2 0 . 1N A D . 标准状况下, 2g 氦气所含原子数目为 N A |
|
| 9. | 详细信息 |
|
将一定量锌与 100 mL18 mol/L 浓硫酸充分反应后,若锌完全溶解同时产生气体 0.8 mol ,将反应后的溶液稀释得 400 mL ,测得溶液 c(H + )=2 mol/L ,则下列叙述中错误的是 A . 反应中生成的气体有 SO 2 和 H 2 B . 反应中共消耗锌 52.0 g C . 气体中 SO 2 和 H 2 物质的量比为 6 : 1 D . 反应共转移电子 1.6 mol |
|
| 10. | 详细信息 |
|
下列有关金属及其化合物的说法正确的是 ( ) A . 铝和氢氧化钠溶液反应生成 Al(OH) 3 和 H 2 O B . Na 加入到过量 FeCl 3 溶液中可置换出 Fe C . 铁在氧气中燃烧生成 Fe 2 O 3 D . 金属单质参与反应时,金属一定失电子 |
|
| 11. | 详细信息 |
|
下列物质间的转化,不能一步实现的是 ( ) A . Na → Na 2 O 2 B . Fe 2 O 3 → Fe(OH) 3 C . Al→NaAlO 2 D . FeCl 3 → FeCl 2 |
|
| 12. | 详细信息 | |||||||||||||||||||||||||
|
下列有关括号内少量杂质的检验试剂、除杂试剂、除杂方法都正确的是
A . A B . B C . C D . D |
||||||||||||||||||||||||||
| 13. | 详细信息 |
|
只用一种试剂,可区别 Na 2 CO 3 、 AlCl 3 、 NH 4 NO 3 、 MgSO 4 四种溶液,这种试剂是 A . HCl B . BaCl 2 C . NaOH D . AgNO 3 |
|
| 14. | 详细信息 |
|
一块表面已被氧化为 Na 2 O 的钠块 10.8g ,将其投入 100g 水中,产生 0.2gH 2 ,则这块钠表面的氧化钠的质量为 ( ) A . 9.2g B . 10.6g C . 6.2g D . 4.6g |
|
| 15. | 详细信息 |
|
化学与生产生活密切相关。下列说法正确的是 A . CaO 2 可作长途运输鱼苗的供氧剂 B . 用食醋和淀粉可检验食盐里是否加碘 C . NaClO 可用于自来水的杀菌消毒和净化 D . Al 与 MgO 的混合物可作铝热剂用于冶炼 Mg |
|
| 16. | 详细信息 |
|
以某冶金工业产生的废渣 ( 含 Cr 2 O 3 、 SiO 2 及少量的 Al 2 O 3 ) 为原料,根据下列流程可制备 K 2 Cr 2 O 7 。 下列说法正确的是 A . 煅烧时没有发生氧化还原反应 B . 滤渣 Ⅱ中主要成分是 Al(OH) 3 C . 可循环使用的物质是 CO 2 和 Na 2 CO 3 D . 由 Na 2 CrO 4 转化为 K 2 Cr 2 O 7 的过程中需加入 KOH |
|
| 17. | 详细信息 |
|
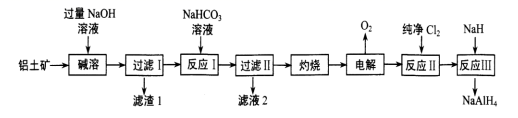
铝氢化钠 (NaAlH 4 ) 是有机合成中的一种重要还原剂。以铝土矿 ( 主要成分为 Al 2 O 3 ,含 SiO 2 和 Fe 2 O 3 等杂质 ) 为原料制备铝氢化钠的一种工艺流程如图: 下列说法中错误的是 A . 为了提高 “ 碱溶 ” 效率,在 “ 碱溶 ” 前对铝土矿进行粉碎 B . “ 反应 I” 的部分化学原理与泡沫灭火器的原理相同 C . “ 滤渣 1” 的主要成分为氧化铁 D . “ 反应 III” 的化学方程式为 4NaH+AlCl 3 =NaAlH 4 +3NaCl |
|
| 18. | 详细信息 |
|
下列关于合金的说法正确的是 ( ) ① 合金只能由两种或两种以上的金属组成 ② 合金具有金属特性 ③ 碳钢和生铁的主要成分相同,故性能相同 ④ 改变原料的配比及生成合金的条件,可得到具有不同性能的合金 A . ②③ B . ②④ C . ①② D . ①④ |
|
| 19. | 详细信息 |
|
下列有关物质的性质与用途正确且具有对应关系的是 A . FeCl 3 具有还原性,可用作铜制线路板的蚀刻剂 B . Al 2 O 3 熔点高,可用作耐高温材料 C . Fe 2 O 3 能与盐酸反应,可用于制作红色颜料 D . Na 2 O 2 具有强氧化性,可用于防毒面具 |
|
| 20. | 详细信息 |
|
甲乙两烧杯中各盛有 600mL 相同浓度的盐酸和氢氧化钠溶液。向两烧杯中分别加入等质量的 16.2g 铝粉,反应结束后,测得生成的气体体积比为甲 ∶乙 ①甲烧杯中盐酸不足 ②乙烧杯中铝过量 ③甲烧杯中生成的气体体积为 10.08L ④乙烧杯中 A . ①④ B . ②④ C . ②③ D . ①③ |
|
| 21. | 详细信息 |
|
除去镁粉中的少量铝粉,可以选用的试剂是 ( ) A . 氢氧化钠溶液 B . 稀盐酸 C . 蒸馏水 D . 硫酸镁溶液 |
|
| 22. | 详细信息 |
|
下列叙述中,正确的是 ( ) A . 5.6 g Fe 与足量 O 2 完全反应生成 Fe 3 O 4 ,转移电子数目为 0.3×6.02×10 23 B . 在常温常压下, 1 mol Al 与足量烧碱溶液完全反应生成 33.6 L H 2 C . 0.1 mol Na 在空气中完全燃烧,消耗 0.1 mol O 2 D . Fe 、 Na 分别与水蒸气、水反应产生的气体体积相同时 ( 同温同压 ) ,消耗的 Fe 和 Na 的质量之比为 21 ∶ 23 |
|
| 23. | 详细信息 |
|
欲除去镁粉中混有的少量铝粉,应选用的试剂是 ( ) A . 稀盐酸 B . 硫酸铜溶液 C . 氨水 D . 氢氧化钠溶液 |
|
| 24. | 详细信息 |
|
下列对于金属的叙述不正确的是 ( ) A . 在点燃 Mg 、 Al 之前,应先用砂纸将其打磨,除去表面的氧化膜 B . 将用砂纸打磨过的铝条放在酒精灯上加热至熔化,铝会滴落下来 C . 铁在氧气中燃烧的现象是剧烈燃烧,火星四射,生成黑色固体,放出大量的热 D . 金属元素在自然界中多以化合态的形式存在 |
|
| 25. | 详细信息 |
|
氯化亚铜 (CuCl) 是白色粉末,微溶于水,酸性条件下不稳定,易生成金属 Cu 和 Cu 2+ ,广泛应用于化工和印染等行业。某研究性学习小组拟热分解 CuC1 2 •2H 2 O 制备 CuCl ,并进行相关探究。下列说法不正确的是 ( ) A . 途径 1 中产生的 Cl 2 可以回收循环利用 B . 途径 2 中 200 ℃时反应的化学方程式为: Cu 2 (OH) 2 Cl 2 C . CuCl 与稀硫酸反应的离子方程式为: 2CuCl+4H + +SO D . X 气体是 HCl ,目的是抑制 CuCl 2 •2H 2 O 加热过程可能的水解 |
|
| 26. | 详细信息 |
|
2019 年 12 月 27 日晚,长征五号运载火箭 “ 胖五 ” 在海南文昌航天发射场成功将实践二十号卫星送入预定轨道。下列有关说法正确的是 ( ) A . 火箭箭体采用铝合金是为了美观耐用 B . 火箭燃料燃烧时将热能转化为化学能 C . 胖五 ” 利用液氧和煤油为燃料,煤油为混合物 D . 卫星计算机芯片使用高纯度的二氧化硅 |
|
| 27. | 详细信息 |
|
下列叙述正确的是 ( ) A . 浓硫酸是一种干燥剂,能够干燥氢气、氧气等气体,但不能干燥碱性气体和有较强还原性的 HI 、 H 2 S 等气体 B . 浓硫酸与单质碳反应的化学方程式为 C + 2H 2 SO 4 ( 浓 ) C . 把足量铜粉投入到含 2 mol H 2 SO 4 的浓硫酸中,加热得到气体体积标准状况下为 22.4 L D . 常温下能够用铁、铝等容器盛放浓硫酸,是因为浓硫酸与其不反应 |
|
| 28. | 详细信息 |
|
金属材料的发展极大地促进了人类社会的文明程度。如图是两种金属及其化合物的转化关系。下列说法不正确的是 A . 根据反应 ③可知氧化性: Fe 3 + >H 2 O 2 B . 向 X 溶液中滴入 C . 反应 ③中稀硫酸仅表现酸性 D . 反应 ①的离子方程式为 Cu + H 2 O 2 + 2H + =Cu 2 + + 2H 2 O |
|
| 29. | 详细信息 |
|
下列物质用途的叙述 不正确 的是 A . 明矾可用作净水剂 B . 氧化铝可用于制造耐火坩埚 C . 油脂可用于制肥皂 D . 单质硅可用于制造光纤制品 |
|
| 30. | 详细信息 |
|
下列有关金属及其化合物的 不合理 的是 ( ) A . 将废铁屑加入 B . 铝中添加适量钾,制得低密度、高强度的铝合金,可用于航空工业 C . 盐碱地 ( 含较多 D . 无水 CoCl 2 呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水 |
|
| 31. | 详细信息 |
|
硫化氢的转化是资源利用和环境保护的重要研究课题。将 H 2 S 和空气的混合气体通入 FeCl 3 、 CuCl 2 的混合溶液中反应回收 S ,其物质转化过程如下图所示。下列叙述不正确的是 A . 反应过程中, CuCl 2 、 FeCl 3 可以循环利用 B . 反应的总方程式为: 2H 2 S+O 2 C . 由图示的转化可得出:氧化性的强弱顺序为 O 2 > Cu 2+ > S D . 保持溶液中 Fe 3+ 的量不变,反应中消耗标况下 22.4L 的 O 2 ,可以生成 64g 硫 |
|
| 32. | 详细信息 |
|
下列混合物分离 ( 或除杂 ) 的方法正确的是 A . 除去 Mg 粉中的 Al 粉:加入足量 NaOH 溶液后,过滤、洗涤 B . 除去 Cl 2 中混有的 HCl 气体:先后通过饱和的碳酸氢钠溶液、浓硫酸 C . 除去 NaHCO 3 溶液中的 Na 2 CO 3 :加入适量稀盐酸 D . 除去中 FeCl 3 溶液中的少量 FeCl 2 :加入适量酸性高锰酸钾溶液 |
|
| 33. | 详细信息 |
|
下列说法不正确的是 A . 铁与水蒸气在高温下反应的产物为 Fe(OH) 3 和 H 2 B . Na 2 O 2 常用作潜水艇或呼吸面具的供氧剂 C . 配制 FeSO 4 溶液时,可在溶液中加入少量铁粉 D . 常用铝箔作包装材料是因其有良好的延展性 |
|
| 34. | 详细信息 |
|
地壳中含量最多的金属元素与海洋中含量最多的非金属元素之间形成的化合物是 A . NaCl B . MnO 2 C . MgO D . Al 2 O 3 |
|
| 35. | 详细信息 |
|
下列说法错误的是 ( ) A . 将饱和的氯化铁溶液分别滴加到加热至沸的蒸馏水中,能制备氢氧化铁胶体 B . 氧化铝溶于水可得到氢氧化铝 C . 过氧化钠和水、二氧化碳反应都有氧气生成 D . 金属元素在地壳中含量:铝>铁>钙>钠 |
|
| 36. | 详细信息 |
|
要除去铁粉中混有的少量铝粉,可选用下列试剂中的 ( ) A . 盐酸 B . 醋酸 C . 氢氧化钠溶液 D . 氨水 |
|
| 37. | 详细信息 |
|
下列说法不正确的是 A . 氯气可用于自来水的消毒 B . 硬铝是制造飞机和字宙飞船的理想材料 C . 氧化铁常用作油漆和橡胶的红色颜料 D . 二氧化硫不可用于漂白纸浆 |
|
| 38. | 详细信息 |
|
实验室中的下列做法不合理的是 ①实验室中钠着火时,用泡沫灭火器灭火 ②实验室保存氯化亚铁溶液时加入适量铁粉 ③用水除去 Cl 2 气体中的 HCl ④用水除去一氧化氮气体中的二氧化氮 ⑤用浓硫酸干燥氨气 ⑥用氢氧化钠溶液除去氧化铁中的氧化铝 A . ①②③ B . ③④⑤ C . ①③⑤ D . ②④⑥ |
|
| 39. | 详细信息 |
|
下列有关物质的性质或应用的说法不正确的是 ( ) A . 重要的炼铜、炼铁矿石黄铜矿的化学式为: CuFeS 2 B . 水晶、石英、玻璃、水泥都是常见的硅酸盐材料 C . 丁达尔效应是区分胶体与溶液的一种常用方法 D . MgO 、 Al 2 O 3 熔点高,可用于制作耐火材料 |
|
| 40. | 详细信息 |
|
将等物质的量的镁和铝均匀混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是 ( ) ①3 mol∙L −1 的盐酸 ②4 mol∙L −1 的 Ba(OH) 2 溶液 ③5 mol∙L −1 的 NaOH 溶液 ④4 mol∙L −1 的 H 2 SO 4 溶液 A . ①③ B . ②③ C . ①④ D . ②④ |
|
| 41. | 详细信息 |
|
等质量的铁粉分别与足量的盐酸、水蒸气在一定的条件下充分反应,则在相同的条件下,产生氢气的质量之比是 ( ) A . 1∶1 B . 3∶4 C . 2∶3 D . 4∶3 |
|
| 42. | 详细信息 |
|
为除去括号内的杂质,所选用的试剂或方法不正确的是 ( ) A . FeCl 2 溶液 (FeCl 3 ) :加入过量铁粉,过滤 B . Fe 2 O 3 (Al 2 O 3 ) :加入 NaOH 溶液,过滤 C . SO 2 (SO 3 ) :浓硫酸,洗气 D . NaNO 3 溶液 (Na 2 SO 4 ) :加入适量的 BaCl 2 溶液 |
|
| 43. | 详细信息 |
|
下列说法不正确的是 ( ) A . 铁粉与氧化铝发生的铝热反应可用于焊接铁轨 B . 钛合金、耐热合金和形状记忆合金等新型合金广泛应用于航空航天、生物工程等领域 C . 熟石膏与水混合成糊状后能很快凝固,常用于制作模型和医疗石膏绷带 D . 工业上可用氨水消除燃煤烟气中的二氧化硫 |
|
| 44. | 详细信息 |
|
下列物质中,不能由单质直接化合生成的是 A . CuCl 2 B . FeCl 2 C . Na 2 O D . Al 2 O 3 |
|
| 45. | 详细信息 |
|
下列物质既能和酸又能和碱反应的是 ( ) A . O 2 B . KOH C . HNO 3 D . Al 2 O 3 |
|
| 46. | 详细信息 |
|
铝具有较强的抗腐蚀性能,主要是因为 ( ) A . 与氧气在加热时才反应 B . 铝性质不活泼,不与任何物质反应 C . 铝表面能形成一层氧化膜,氧化膜对其起保护作用 D . 铝和酸不反应 |
|
| 47. | 详细信息 |
|
下列属于合金的是 ( ) A . 不锈钢 B . 黄金 C . 石墨 D . 氧化铁 |
|
| 48. | 详细信息 |
|
向相同体积、相同浓度的盐酸和氢氧化钠溶液中分别放入足量铝粉,放出的氢气在同温同压下的体积比为 ( ) A . 1 : 3 B . 1 : 6 C . 1 : 1 D . 3 : 2 |
|
| 49. | 详细信息 |
|
下列关于金属的说法正确的是 A . 铝箔在空气中受热可以熔化且会发生剧烈燃烧 B . 铝制餐具不宜用来蒸煮酸性或碱性食物 C . 铁与氧气燃烧的产物是红色的 Fe 2 O 3 D . Na 在空气中燃烧,发出黄色火焰,生成白色固体 |
|
| 50. | 详细信息 |
|
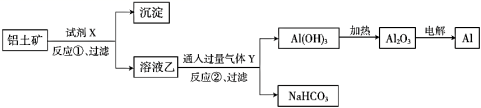
工业上用铝土矿 ( 主要成分为 A . 试剂 X 是稀盐酸或稀硫酸 B . 反应 ①过滤后所得沉淀为氢氧化铁 C . 反应 ②通入的过量气体 Y 是 |
|