2017й«ҳдәҢдёӢеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰејҖеӯҰиҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗдёӯпјҢз”өеӯҗж•°еӨ§дәҺиҙЁеӯҗж•°дё”иҙЁеӯҗж•°еӨ§дәҺдёӯеӯҗж•°зҡ„жҳҜпјҲВ В пјү A.D3O+В В В В В В В В В В B.Li+В В В В В В В В В В В В В В C.ODВҜВ В В В В В В В В В D.OHВҜ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
з”Ёе·ІзҹҘжө“еәҰзҡ„й…ёж»ҙе®ҡжңӘзҹҘжө“еәҰзҡ„зўұж—¶пјҢеҜјиҮҙеҫ…жөӢзўұж¶Ізҡ„жө“еәҰеҒҸдҪҺзҡ„жҳҜ(В В В ) в‘ й…ёејҸж»ҙе®ҡз®Ўз”Ёи’ёйҰҸж°ҙжҙ—еҗҺпјҢжңӘз”Ёж ҮеҮҶж¶Іж¶Ұжҙ—В В В в‘ЎзўұејҸж»ҙе®ҡз®Ўз”Ёи’ёйҰҸж°ҙжҙ—еҗҺпјҢжңӘз”Ёеҫ…жөӢж¶Іж¶Ұжҙ— в‘ўй…ҚеҲ¶зўұж¶Іж—¶пјҢз§°йҮҸзҡ„еӣәдҪ“еҗёжҪ®В В В В В В В В В В В В В В В в‘Јж»ҙе®ҡеүҚй…ёејҸж»ҙе®ҡз®Ўе°–еҳҙйғЁеҲҶжңӘе……ж»Ўжә¶ж¶І в‘Өж»ҙе®ҡдёӯдёҚж…Һе°Ҷй”ҘеҪўз“¶еҶ…ж¶ІдҪ“ж‘ҮеҮәе°‘йҮҸдәҺ瓶еӨ– A. в‘ в‘ўв‘ЈВ В В В B. в‘Ўв‘ӨВ В В C. в‘Ўв‘ўв‘ӨВ В В В В D. в‘ в‘ў
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘзғӯеҢ–еӯҰж–№зЁӢејҸпјҡ в‘ C2H2(g) + в‘Ў C(s)+ O2(g) == CO2(g)В в–іH2пјқ-393.5 kJвҖўmol-1 в‘ў H2(g)+ еҲҷеҸҚеә”в‘Ј 2C(s)+ H2(g) == C2H2(g)зҡ„в–іHдёәпјҲВ В В пјү A. +228.2 kJВ·mol-1В В В В В В В В B. -228.2 kJВ·mol-1В В В C. +1301.0 kJВ·mol-1В В В В В В В D. +621.7 kJВ·mol-1
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҺҹеӯҗжҲ–зҰ»еӯҗеҺҹеӯҗж ёеӨ–з”өеӯҗжҺ’еёғдёҚеұһдәҺеҹәжҖҒжҺ’еёғзҡ„жҳҜ(В В ) A. N:В В 1s22s22p3В В В В В В В В В В В B. S2-:В В 1s22s22p63s23p6 C. Na:В 1s22s22p53s2В В В В В В В В D. Si:В В 1s22s22p63s23p2
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁ0.1 molВ·LпјҚ1 CH3COOHжә¶ж¶ІдёӯеӯҳеңЁеҰӮдёӢз”өзҰ»е№іиЎЎпјҡ В CH3COOH В A.еҠ е…Ҙж°ҙж—¶пјҢе№іиЎЎеҗ‘йҖҶеҸҚеә”ж–№еҗ‘移еҠЁ В B.еҠ е…Ҙе°‘йҮҸNaOHеӣәдҪ“пјҢе№іиЎЎеҗ‘жӯЈеҸҚеә”ж–№еҗ‘移еҠЁ В В C.еҠ е…Ҙе°‘йҮҸ0.1 molВ·LпјҚ1 HClжә¶ж¶ІпјҢжә¶ж¶Ідёӯc(H+)еҮҸе°Ҹ В В D.еҠ е…Ҙе°‘йҮҸCH3COONaеӣәдҪ“пјҢе№іиЎЎеҗ‘жӯЈеҸҚеә”ж–№еҗ‘移еҠЁ
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёӢеҲ—еӣӣз§Қжә¶ж¶ІдёӯпјҢеҠ е…Ҙд»ҘдёӢеҗ„з§ҚзҰ»еӯҗпјҢеҗ„зҰ»еӯҗиғҪеңЁеҺҹжә¶ж¶ІдёӯеӨ§йҮҸе…ұеӯҳзҡ„жңүпјҲпјү AгҖҒж»ҙеҠ зҹіи•ҠиҜ•ж¶ІжҳҫзәўиүІзҡ„жә¶ж¶ІпјҡFe3+ гҖҒNH4+ гҖҒClпјҚ гҖҒIпјҚ BгҖҒpHеҖјдёә1зҡ„жә¶ж¶ІпјҡCu2+гҖҒNa+ гҖҒMg2+гҖҒNO3- CгҖҒж°ҙз”өзҰ»еҮәжқҘзҡ„c(H+)=10пјҚ13mol/Lзҡ„жә¶ж¶ІпјҡK+гҖҒHCO3-гҖҒBrпјҚгҖҒBa2+ В DгҖҒжүҖеҗ«жә¶иҙЁдёәNa2SO4зҡ„жә¶ж¶ІпјҡK+ гҖҒCO32-гҖҒNO3-гҖҒAl3+
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҲҶеӯҗжҲ–зҰ»еӯҗдёӯпјҢеҗ«жңүеӯӨеҜ№з”өеӯҗзҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲВ В В В В пјү AпјҺH2OВ В В В В BпјҺCH4В В В В В В CпјҺSiH4 В В В В В В В В В DпјҺNH4+
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёҖе®ҡжқЎд»¶дёӢпјҢеҪ“64gSO2ж°”дҪ“иў«ж°§еҢ–жҲҗSO3ж°”дҪ“ж—¶пјҢе…ұж”ҫеҮәзғӯйҮҸ98.3KJпјҢе·ІзҹҘSO2еңЁжӯӨжқЎд»¶дёӢиҪ¬еҢ–зҺҮдёә80%пјҢжҚ®жӯӨпјҢдёӢеҲ—зғӯеҢ–еӯҰж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјүВ В В В AпјҺSO2пјҲgпјүпјӢ1/202пјҲgпјү BпјҺ2SO2пјҲgпјүпјӢO2пјҲgпјү CпјҺSO2пјҲgпјүпјӢ1/2O2пјҲgпјү DпјҺ2SO2пјҲgпјүпјӢO2пјҲgпјү
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҖе®ҡжқЎд»¶дёӢпјҢеңЁе®№з§Ҝдёә10Lзҡ„еҜҶй—ӯе®№еҷЁдёӯпјҢе°Ҷl mol Xе’Ң1 mol YиҝӣиЎҢеҰӮдёӢеҸҚеә”пјҡ2X(g)пјӢY(g) В AпјҺ60 sж—¶Zзҡ„е№іиЎЎжө“еәҰдёә0.03 mol/LВ В В BпјҺе°Ҷе®№еҷЁе®№з§ҜеҸҳдёә20 LпјҢZзҡ„ж–°е№іиЎЎжө“еәҰе°ҶзӯүдәҺеҺҹе№іиЎЎжө“еәҰзҡ„дёҖеҚҠ В CпјҺиӢҘжё©еәҰе’ҢдҪ“з§ҜдёҚеҸҳпјҢеҫҖе®№еҷЁеҶ…еўһеҠ 1 mol YпјҢYзҡ„иҪ¬еҢ–зҺҮе°ҶеўһеӨ§ DпјҺиӢҘеҚҮй«ҳжё©еәҰпјҢXзҡ„дҪ“з§ҜеҲҶж•°еўһеӨ§пјҢеҲҷжӯЈеҸҚеә”зҡ„в–іH > 0
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
еҸҜйҖҶеҸҚеә”mA(s)+nB(g) AпјҺеҲ°иҫҫе№іиЎЎеҗҺпјҢиӢҘдҪҝз”ЁеӮ¬еҢ–еүӮпјҢCзҡ„иҙЁйҮҸеҲҶж•°еўһеӨ§ BпјҺе№іиЎЎеҗҺпјҢиӢҘеҚҮй«ҳжё©еәҰпјҢе№іиЎЎеҲҷеҗ‘жӯЈеҸҚеә”ж–№еҗ‘移еҠЁ CпјҺе№іиЎЎеҗҺпјҢеўһеӨ§Aзҡ„йҮҸпјҢжңүеҲ©дәҺе№іиЎЎеҗ‘жӯЈеҸҚеә”ж–№еҗ‘移еҠЁ DпјҺеҢ–еӯҰж–№зЁӢејҸдёӯдёҖе®ҡnп№Өp+q
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
е®Өжё©дёӢпјҢеңЁpH=12зҡ„жҹҗжә¶ж¶ІдёӯпјҢз”ұж°ҙз”өзҰ»зҡ„c(OHВӯ-)дёәпјҲВ В В пјү гҖҖAпјҺ1.0Г—10-7 mol.L-1гҖҖВ В В В В В В В В В В В В BпјҺ1.0Г—10-6 mol.L-1 гҖҖCпјҺ1.0Г—10-1 mol.L-1гҖҖВ В В В В В В В В В В В В DпјҺ1.0Г—10-12 mol.L-1
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
В зү©иҙЁзҡ„йҮҸжө“еәҰзӣёеҗҢзҡ„дёӢеҲ—жә¶ж¶Ів‘ (NH4)2CO3 в‘Ў(NH4)2SO4 в‘ўNH4HCO3 в‘ЈNH4HSO4 В В В В в‘ӨNH4Cl в‘ҘNH3В·H2OпјӣжҢүc(NH4+)з”ұе°ҸеҲ°еӨ§зҡ„жҺ’еҲ—йЎәеәҸжӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү A.в‘ўв‘Өв‘Јв‘Ҙв‘ в‘ўВ В В B.в‘Ҙв‘ўв‘Өв‘Јв‘ в‘ЎВ В C.в‘Ҙв‘Өв‘ўв‘Јв‘ в‘ЎВ В D.в‘Ҙв‘ўв‘Өв‘Јв‘Ўв‘
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁд№ҷзғҜеҲҶеӯҗдёӯжңү5дёӘПғй”®гҖҒдёҖдёӘПҖй”®пјҢе®ғ们еҲҶеҲ«жҳҜВ В В В В В В В В В В В В В В В В В В В пјҲВ В В В пјү
BпјҺsp2жқӮеҢ–иҪЁйҒ“еҪўжҲҗПҖй”®гҖҒжңӘжқӮеҢ–зҡ„2pиҪЁйҒ“еҪўжҲҗПғй”® CпјҺC-Hд№Ӣй—ҙжҳҜsp2еҪўжҲҗзҡ„Пғй”®пјҢC-Cд№Ӣй—ҙжҳҜжңӘеҸӮеҠ жқӮеҢ–зҡ„2pиҪЁйҒ“еҪўжҲҗзҡ„ПҖй”® DпјҺC-Cд№Ӣй—ҙжҳҜsp2еҪўжҲҗзҡ„Пғй”®пјҢC-Hд№Ӣй—ҙжҳҜжңӘеҸӮеҠ жқӮеҢ–зҡ„2pиҪЁйҒ“еҪўжҲҗзҡ„ПҖй”®
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
еҜ№дәҺйҡҫжә¶зӣҗMXпјҢе…¶йҘұе’Ңжә¶ж¶ІдёӯM+е’ҢX-жө“еәҰд№Ӣй—ҙзҡ„е…ізі»дёәKsp=c(M+)вҖўc(X-)пјҢзҺ°е°Ҷи¶ійҮҸзҡ„AgClеҲҶеҲ«ж”ҫе…ҘдёӢеҲ—зү©иҙЁдёӯпјҢAgClзҡ„жә¶и§ЈеәҰз”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜ пјҲВ В пјү в‘ 20mL0.01molвҖўL-1ВӯKClжә¶ж¶Іпјӣв‘Ў30mL0.02molвҖўL-1CaCl2жә¶ж¶Іпјӣв‘ў40mL0.03molвҖўL-1HClжә¶ж¶Іпјӣв‘Ј10mLи’ёйҰҸж°ҙпјӣв‘Ө50mL0.05molвҖўL-1AgNO3жә¶ж¶І A. в‘ >в‘Ў>в‘ў>в‘Ј>в‘ӨВ В В В В B. в‘Ј>в‘ >в‘ў>в‘Ў>в‘ӨВ В C. в‘Ө>в‘Ј>в‘Ў>в‘ >в‘ўВ В В В В D. в‘Ј>в‘ў>в‘Ө>в‘Ў>в‘
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷ0.2mol/LCH3COOKдёҺ0.1mol/Lзӣҗй…ёзӯүдҪ“з§Ҝж··еҗҲеҗҺпјҢжә¶ж¶ІдёӯдёӢеҲ—зІ’еӯҗзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰзҡ„е…ізі»жӯЈзЎ®зҡ„жҳҜ (В В В )В В В В В AпјҺc(CH3COOпјҚ) = c(ClпјҚ) пјһ c(HпјӢ) пјһ c(CH3COOH)В В BпјҺc(CH3COOпјҚ) = c(ClпјҚ) пјһ c(CH3COOH) пјһ c(HпјӢ) CпјҺc(CH3COOпјҚ) пјһ c(ClпјҚ) пјһ c(HпјӢ) пјһ c(CH3COOH)В DпјҺc(CH3COOпјҚ) пјһ c(ClпјҚ) пјһ c(CH3COOH) пјһ c(HпјӢ)
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
25в„ғж—¶пјҢжҹҗејәй…ёжә¶ж¶ІpH=aпјҢејәзўұжә¶ж¶ІpH=bпјҢдё”a+b=12пјҢй…ёзўұжә¶ж¶Іж··еҗҲеҗҺжә¶ж¶Ізҡ„pH=7пјҢеҲҷй…ёжә¶ж¶Ізҡ„дҪ“з§ҜпјҲV1пјүдёҺзўұжә¶ж¶Ізҡ„дҪ“з§ҜпјҲV2пјүзҡ„е…ізі»жҳҜ(В В В ) В AпјҺV1=102V2гҖҖгҖҖгҖҖВ BпјҺV2=102V1гҖҖгҖҖгҖҖ CпјҺВ V1=2V2гҖҖгҖҖгҖҖВ DпјҺВ V2=2V1
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
еҶҷеҮәдёӢеҲ—зү©иҙЁзҡ„з”өзҰ»ж–№зЁӢејҸ(еңЁж°ҙжә¶ж¶Ідёӯ) (1)NH3В·H2O_____________________________________пјӣ (2)H2CO3_____________________________ __________пјӣ (3)NaHSO4__________________________В В __________пјӣ (4)NaHCO3_____________________В В _______________пјӣ (5)Fe(OH)3______________В В ____________В В В В В В ___гҖӮ
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүжҠҠFeCl2жә¶ж¶ІеҠ зғӯи’ёе№ІпјҢзҒјзғ§пјҢжңҖеҗҺеҫ—еҲ°зҡ„дё»иҰҒеӣәдҪ“дә§зү©жҳҜВ В В В В В В В В пјҲ2пјүзәҜзўұжә¶ж¶ІиғҪйҷӨеҺ»жІ№жұЎгҖӮеҺҹеӣ жҳҜпјҲз”ЁзҰ»еӯҗж–№зЁӢејҸиЎЁзӨәпјҢдёӢеҗҢпјүВ В В В В В В В В В В пјҲ3пјүжҳҺзҹҫ[KAl(SO4)2В·12H2O]иғҪеҒҡеҮҖж°ҙеүӮзҡ„еҺҹеӣ жҳҜВ В В В В В В В В В В В В В В пјҲ4пјүй…ҚеҲ¶зЎ«й…ёй“ңжә¶ж¶ІпјҢз»Ҹеёёе…ҲжҠҠжҷ¶дҪ“жә¶дәҺе°‘йҮҸзЁҖзЎ«й…ёеҗҺпјҢеҶҚеҠ ж°ҙзЁҖйҮҠжҲҗжә¶ж¶ІгҖӮ еҺҹеӣ жҳҜВ В В В В В В В В В В пјҲ5пјүй“өжҖҒж°®иӮҘдёҺиҚүжңЁзҒ°пјҲжҲҗеҲҶжҳҜK2CO3пјүдёҚиғҪж··еҗҲж–Ҫз”ЁгҖӮеҺҹеӣ жҳҜВ В В В В В В В В В В
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
еңЁдёҖе®ҡдҪ“з§Ҝзҡ„еҜҶй—ӯе®№еҷЁдёӯпјҢиҝӣиЎҢеҰӮдёӢеҸҚеә”пјҡ CO2(g)+H2(g)
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ в‘ҙиҜҘеҸҚеә”еҢ–еӯҰе№іиЎЎеёёж•°зҡ„иЎЁиҫҫејҸпјҡK=В В В В В В В В В В пјӣ в‘өиҜҘеҸҚеә”дёәВ В В В В В В пјҲеЎ«вҖңеҗёзғӯвҖқжҲ–вҖңж”ҫзғӯвҖқпјүеҸҚеә”пјӣ ⑶дёӢеҲ—иҜҙжі•дёӯиғҪиҜҙжҳҺиҜҘеҸҚеә”иҫҫе№іиЎЎзҠ¶жҖҒзҡ„жҳҜВ В В В В В В В В В AгҖҒе®№еҷЁдёӯеҺӢејәдёҚеҸҳВ В BгҖҒж··еҗҲж°”дҪ“дёӯc(CO)дёҚеҸҳВ В В CгҖҒж··еҗҲж°”дҪ“зҡ„еҜҶеәҰдёҚеҸҳВ В В В DгҖҒc(CO) = c(CO2)В В В EгҖҒеҢ–еӯҰе№іиЎЎеёёж•°KдёҚеҸҳ FгҖҒеҚ•дҪҚж—¶й—ҙеҶ…з”ҹжҲҗCOзҡ„еҲҶеӯҗж•°дёҺз”ҹжҲҗCO2зҡ„еҲҶеӯҗж•°зӣёзӯү в‘·жҹҗжё©еәҰдёӢпјҢеҗ„зү©иҙЁзҡ„е№іиЎЎжө“еәҰз¬ҰеҗҲдёӢејҸпјҡc(CO2)Г—c(H2)=c(CO)Г—c(H2O)пјҢиҜ•еҲӨжӯӨж—¶зҡ„жё©еәҰдёәВ В В В В В В гҖӮ
|
|||||||||||||
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
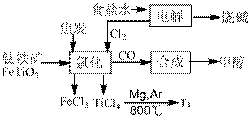
й’ӣ(Ti )иў«з§°дёә继й“ҒгҖҒй“қд№ӢеҗҺзҡ„第дёүйҮ‘еұһгҖӮеҰӮдёӢеӣҫжүҖзӨәпјҢе°Ҷй’ӣеҺӮгҖҒж°ҜзўұеҺӮе’Ңз”ІйҶҮеҺӮз»„жҲҗдә§дёҡй“ҫеҸҜд»ҘеӨ§еӨ§жҸҗй«ҳиө„жәҗеҲ©з”ЁзҺҮпјҢеҮҸе°‘зҺҜеўғжұЎжҹ“гҖӮ иҜ·еЎ«еҶҷдёӢеҲ—з©әзҷҪпјҡ
(l)з”өи§ЈйЈҹзӣҗж°ҙж—¶пјҢжҖ»еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜ__________________________гҖӮ (2)еҶҷеҮәй’ӣй“Ғзҹҝз»Ҹж°ҜеҢ–жі•еҫ—еҲ°еӣӣж°ҜеҢ–й’ӣзҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ_________________гҖӮ (3)е·ІзҹҘпјҡв‘ Mg(s)+Cl2(g)пјқMgCl2(s)В в–іHпјқдёҖ641kJВ·molпјҚ1 в‘ЎTi(s)+2Cl2(g)пјқTiCl4(s)В в–іHпјқдёҖ770kJВ·molпјҚ1 еҲҷ2Mg+TiCl4пјқ2MgCl2+TiВ в–іHпјқ__________________гҖӮ еҸҚеә”2Mg(s)+TiCl4(s) (4)еңЁдёҠиҝ°дә§дёҡй“ҫдёӯ,еҗҲжҲҗ192 t з”ІйҶҮзҗҶи®әдёҠйңҖйўқеӨ–иЎҘе……H2____t (дёҚиҖғиҷ‘з”ҹдә§иҝҮзЁӢдёӯзү©иҙЁзҡ„д»»дҪ•жҚҹеӨұ). (5)д»Ҙз”ІйҶҮгҖҒз©әж°”гҖҒж°ўж°§еҢ–й’ҫжә¶ж¶ІдёәеҺҹж–ҷпјҢзҹіеўЁдёәз”өжһҒеҸҜжһ„жҲҗзҮғж–ҷз”өжұ гҖӮиҜҘз”өжұ дёӯиҙҹжһҒдёҠзҡ„з”өжһҒеҸҚеә”ејҸжҳҜ____________________________________________гҖӮ
|
|
- дёҠжө·еёӮй«ҳдёүеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•йўҳеёҰзӯ”жЎҲе’Ңи§Јжһҗ
- 2018иҮі2019е№ҙй«ҳдёҖдёӢеҶҢжңҹдёӯиҖғиҜ•еҢ–еӯҰиҜ•еҚ·е®Ңж•ҙзүҲпјҲеҗүжһ—зңҒй•ҝжҳҘеёӮеӨ–еӣҪиҜӯеӯҰж Ўпјү
- 2018-2019е№ҙй«ҳдәҢдёҠеҚҠе№ҙ第дёүж¬ЎжңҲиҖғеҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲпјҲжұҹиҘҝзңҒеҚ—жҳҢеёӮ第дәҢдёӯеӯҰпјү
- дә‘еҚ—зңҒжӣІйқ–еёӮ第дәҢдёӯеӯҰгҖҒеӨ§зҗҶж–°дё–зәӘдёӯеӯҰ2021еұҠй«ҳдёү第дёҖж¬ЎжЁЎжӢҹиҖғиҜ•зҗҶ科综еҗҲеҢ–еӯҰйўҳеҗҢжӯҘи®ӯз»ғе…Қиҙ№иҜ•еҚ·
- йІҒ科зүҲйҖүжӢ©жҖ§еҝ…дҝ®1第2з« еҢ–еӯҰеҸҚеә”зҡ„ж–№еҗ‘гҖҒйҷҗеәҰдёҺйҖҹзҺҮ第3иҠӮеҢ–еӯҰеҸҚеә”зҡ„йҖҹзҺҮиҜҫж—¶2еҪұе“ҚеҢ–еӯҰеҸҚеә”йҖҹзҺҮзҡ„еӣ зҙ
- иҫҪе®ҒжІҲйҳіеёӮ第дәҢеҚҒе…«дёӯеӯҰ2020--2021е№ҙй«ҳдёҖдёҠеӯҰжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§Јжһҗ
- е®ңе®ҫеёӮй«ҳдәҢеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·е…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- жҷ®жҙұеёӮй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•йўҳе…Қиҙ№иҜ•еҚ·