2018高三上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
下列表示物质结构的化学用语或模型图正确的是 A.HClO的结构式:H-O-Cl B.H2O2的电子式:H+[∶ C.CO2的比例模型:
|
|
| 2. | 详细信息 |
|
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为11;Y、Z在同一 周期;Z原子最外层电子数是X原子内层电子数的2倍,也是Y原子最外层电子数的2倍。下列说 法中,正确的是 A.离子半径:Y>X B.气态氢化物的稳定性:Z>X C.Y的氧化物中含有离子键 D.Z的氧化物对应的水化物是弱碱
|
|
| 3. | 详细信息 |
|
下列物质中,长期置于空气中会发生颜色变化的是 ①绿矾 ②氢氧化亚铁 ③氯水 ④硫酸铜 ⑤亚硫酸钠 ⑥过氧化钠 A.全部 B.只有①②③ C.①②③④⑥ D.②③④⑤⑥
|
|
| 4. | 详细信息 |
|
盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的。 已知:H2O(g)=H2O(l) △H1=-Q1kJ∕mol C2H5OH(g)=C2H5OH(l) △H2=-Q2kJ∕mol C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3kJ∕mol 若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为 A.(Q1+Q2+Q3)kJ B.0.5(Q1+Q2+Q3)kJ C.(0.5Q1-1.5Q2+0.5Q3)kJ D.(1.5Q1-0.5Q2+0.5Q3)kJ
|
|
| 5. | 详细信息 |
|
制备干燥氨气所需的药品是 A.NH4Cl溶液、NaOH溶液、CaCl2固体 B.饱和氨水 C.NaOH溶液、NH4Cl晶体、浓H2SO4 D.NH4Cl固体、碱石灰、消石灰
|
|
| 6. | 详细信息 |
|
下列各组离子一定能大量共存的是 A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- B.在强碱性溶液中:Na+、K+、AlO2-、CO32- C.在c(H+)=10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3- D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
|
|
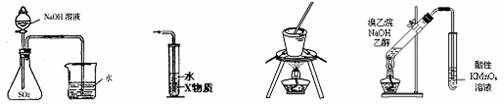
| 7. | 详细信息 |
|
下列装置或操作能达到实验目的的是 ① ② ③ ④ A.装置①可用于证明SO2与NaOH溶液发生了反应 B.装置②中X为CCl4,可用于吸收氨气或氯化氢 C.装置③可用于实验室从食盐水中提取氯化钠 D.装置④可用于证明溴乙烷与NaOH醇溶液共热生成乙烯
|
|
| 8. | 详细信息 |
|
用NA表示阿伏加德罗常数的值。下列叙述正确的是 A.常温下,2.24LN2和O2的混合气体所含原子数为0.2NA B.常温下,pH=2的醋酸溶液中所含有的H+数为0.01NA C.标准状况下,30g NO和16g O2混合所生成的气体分子数为NA D.标准状况下,6.72L CO2中所含的共用电子对数为1.2NA
|
|
| 9. | 详细信息 |
|
下列离子方程式中正确的是 A.向Ba(NO)2溶液中通入CO2气体:Ba2++CO2+H2O=BaCO3↓+2H+ B.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2===Fe3++2H2O C.过量的二氧化碳通入漂白粉溶液中:ClO-+CO2+H2O===HClO+HCO3- D.AlCl3溶液中加入过量氨水:Al3++4NH3·H2O===AlO2-+2H2O+4NH4+
|
|
| 10. | 详细信息 |
|
下列物质间发生化学反应:①Na+O2 ②NH3·H2O+SO2 ③Cu + HNO3 ④FeBr2 +Cl2 ⑤Fe +HCl ⑥Zn +H2SO4 ⑦NaHCO3 + HCl,在不同条件(温度、浓度、用量等)下能得到不同产物的是 A. ①②③④⑥⑦ B. ①②③④⑥ C. ①②④⑤⑥ D. ①②③④⑤
|
|
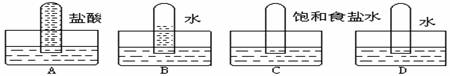
| 11. | 详细信息 |
|
四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生的现象如下图所示,其中充满Cl2的试管是
|
|
| 12. | 详细信息 |
|
已知一定温度和压强下,合成氨反应:N2(g)+3H2(g) A.Q1 + Q2 = 92.0KJ B.α1 + α2 = 1 C.Q1 + Q2 = 184.0KJ D.α1/α2 = Q1/ Q2
|
|
| 13. | 详细信息 | |||||||||||||||
|
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
|
||||||||||||||||
| 14. | 详细信息 |
|
铅蓄电池在现代生活中有广泛应用,其电极材料是Pb和PbO2,电解液是硫酸溶液。现用 铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确 的是 A.蓄电池放电时,每消耗0.1molPb,共生成0.1mol PbSO4 B.电解硫酸钠溶液时的阳极反应式为:4OH- — 4e- = 2H2O + O2↑ C.电解后,硫酸钠溶液中有晶体析出,所以c(Na2SO4)会变小 D.蓄电池放电一段时间后其电解液中H2SO4的浓度、密度都不会改变
|
|
| 15. | 详细信息 |
|
某化学课外小组模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。已知:NO2(g)
(1)写出装置A中主要反应的化学方程式 (2)如何检查装置A的气密性 (3)已知1molNO2与液态水反应生成HNO3溶液和NO气体放出热量45.5kJ,写出该反应的热化学方程式 ,该反应是一个可逆反应,欲要提高NO2的转化率,可采取的措施是____。 A.升高温度 B.降低温度 C.增大压强 D.减小压强 (4)实验结束后,关闭止水夹b、c,将装置D,浸入冰水中,现象是______ (5)装置C中浓H2SO4的作用是 (6)请你帮助该化学小组设计实验室制取NH3的另一方案 (用化学反应方程式表示)
|
|
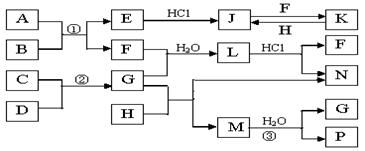
| 16. | 详细信息 |
|
下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。已知:E为红棕色固体,K为浅绿色溶液;反应②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G为常见的致冷剂,化合物M由两种元素组成,分子内共有58个电子。
(1)化合物A中含有的两种元素是 (写元素符号),M的化学式_______ (2)如何检验化合物N中的阳离子 (3)写出K与H反应的离子方程式: ;C与D反应的化学方程式: 。 (4)等物质的量F和H的混合气体通入品红溶液中的现象为 ,原因是(用离子反应方程式表示) (5)实验中可用NaOH溶液来吸收多余的H,请写出此离子反应方程式
|
|
| 17. | 详细信息 |
|
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问 题: (1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的 固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是 ;X与过量浓硝酸反应后溶液中含有的盐的化学式为 。 (2)某溶液中有Mg2+、Fe2+、A13+、Cu2+等四种离子,向其中加入过量的NaOH溶液后, 过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是 ; A.Mg2+ B.Fe2+ C.A13+ D.Cu2+ (3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
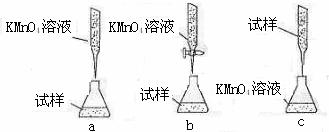
回答下列问题: ①操作I的名称是 ;操作II的方法为 。 ②Na2CO3溶液可以除油污,原因是(用离子方程式表示) ; ③请完成生成FeCO3沉淀的离子方程式 。 (4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定 (5Fe2++MnO-4+8H+====5Fe3++Mn2++4H2O) ① 实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要 的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 。 ②该实验中的KMnO4溶液需要酸化,用于酸化的酸是 。 A.稀硝酸 B.稀盐酸 C.稀硫酸 D.浓硝酸 ③某同学设计的下列滴定方式,最合理的是 。(夹持部分略去)(填字母序号)
|
|
| 18. | 详细信息 |
|
某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干 种组成,取该溶液进行如下实验: (a)取适量溶液,加入过量盐酸,有气体生成,并得到无色透明溶液; (b)向(a)所得溶液中加入过量碳酸氢铵溶液,有气体生成,且析出白色沉淀甲; (c)向(b)所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。 根据上述实验回答下列问题: (1)溶液中一定不存在的离子是____________________。 (2)溶液中一定存在的离子是____________________。 (3)判断沉淀乙成分的方法是______________________________。 (4)写出(b)中反应的离子方程式 。
|
|