福建高三上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
生活中常用到一些化学知识,下列分析中正确的是 ( ) A.NaHCO3能与碱反应,所以可用作焙制糕点的膨松剂 B.加碘食盐中添加碘酸钾而不用碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水 C.焰火的五彩缤纷是某些金属元素化学性质的展现 D.民间常用明矾作净水剂,目的是除去水中的悬浮杂质 |
|
| 2. | 详细信息 | ||||||||||||||||||||
|
大多数物质的俗名是根据其特殊的物理性质或用途得来的。下列物质的俗名与化学式或用途不相符的一组是( )
|
|||||||||||||||||||||
| 3. | 详细信息 |
|
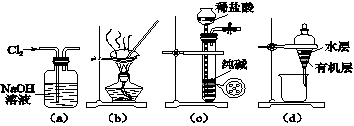
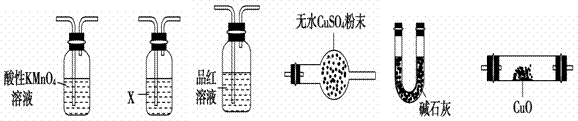
用下列实验装置进行相应实验,能达到实验目的的是( )
A.用图(a)所示装置除去Cl2中含有的少量HCl B.用图(b)所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 C.用图(c)所示装置制取少量纯净的CO2气体并控制反应的发生和停止 D.用图(d)所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
|
| 4. | 详细信息 |
|
根据下列实验事实判断所测液体样品最有可能是纯水的是( ) A.一定温度下,测定其pH等于7 B.一个标准大气压下,测定其沸点为100℃ C.电解,产生H2、O2的体积比为2:1 D.室温时为无色、无味的液体 |
|
| 5. | 详细信息 |
|
下列有关苯乙烯( A.苯乙烯与乙烯互为同系物 B.所有原子可能在同一平面 C.可使酸性KMnO4溶液褪色 D.可发生加成反应 |
|
| 6. | 详细信息 |
|
下列化学方程式或离子方程式正确的是( ) B.少量SO2通入氢氧化钠溶液中:OH-+SO2=HSO3- |
|
| 7. | 详细信息 |
|
短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、W处于同一主族,Y、Z的原子最外层电子数之和等于9,X 的简单氢化物与W的单质组成的混合气体见光可生成W的氢化物和油状混合物。下列说法正确的是( ) A.简单离子半径:Y<Z<W B.W 的氧化物对应的水化物的酸性一定比X 的强 C.Y的简单气态氢化物的热稳定性一定比W的强 D.Y 分别与X、Z形成的化合物,其所含化学键的类型相同 |
|
| 8. | 详细信息 |
|
下列有关化学用语表示不正确的是( )
C.CO2分子的结构式: |
|
| 9. | 详细信息 |
|
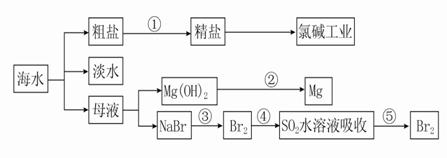
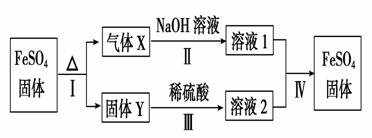
A. 除去粗盐中的SO 液→NaOH溶液→BaCl2溶液→过滤后加盐酸 B. ②中包含制取MgCl2溶液、无水MgCl2及电解熔融状态的MgCl2几个阶段 C. ③④⑤中溴元素均被氧化 D. 蒸馏法是技术最成熟也是最具发展前景的海水淡化方法 |
|
| 10. | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的是( ) A.标准状况下,22.4 L的CCl4中含CCl4分子数为NA B.5.6 g铁和6.4 g铜分别与0.1 mol氯气完全反应,转移的电子数相等 C.0.1 mo1·L-1 MgCl2溶液中含Cl-数为0.2NA D.3.9 g Na2O2 晶体中含有的离子总数为0.2NA |
|
| 11. | 详细信息 |
|
下列物质的转化在给定条件下能实现的是( ) ①氯化钠饱和溶液 ② Al2O3 ③海水 ④N2 ⑤重晶石(BaSO4) A.①③⑤ B.②③④ C.②④⑤ D.①②⑤ |
|
| 12. | 详细信息 |
|
LiAlH4是重要的储氢材料,其组成类似Na3AlF6。常见的供氢原理如下两个方程式所示:①2LiAlH4 A.若反应①中生成3.36 L氢气,则一定有2.7 g铝生成 B.氢化锂也是一种储氢材料,供氢原理为:LiH+H2O C.生成等质量的氢气,反应①、②转移电子数之比为4∶3 D.LiAlH4是共价化合物,LiH是离子化合物 |
|
| 13. | 详细信息 |
|
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是 ( ) ①过量的锌与18 mol·L—1的硫酸反应; ②过量的氢气与少量氮气在催化剂存在下充分反应; ③浓盐酸与过量的MnO2; ④过量铜与浓硫酸; ⑤过量稀硝酸与银反应; ⑥过量稀硫酸与块状石灰石 C.②③④⑥ D.①②③④⑤⑥ |
|
| 14. | 详细信息 | |||||||||||||||
|
化学与社会、生活密切相关。对下列现象或事实的解释正确的是( )
|
||||||||||||||||
| 15. | 详细信息 |
|
在Fe2(SO4)3溶液中,加入a g铜,完全溶解后,再加b g铁,充分反应后得到c g残余固体,且a>c,则下列说法正确的是( ) A.最后得到的溶液中一定含有Cu2+ B.残余固体是铜和铁 C.将残余固体加入到稀H2SO4中,有气泡产生 D.最后得到的溶液中可能含有Fe3+
|
|
| 16. | 详细信息 | ||||||||||
|
现有部分短周期元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代,该核素的原子核内有8个中子,则这种同位素的符号是________。 (2)元素Y的单质的电子式为 ,元素Y和元素Z可形成一种各原子最外层均为8电子结构的化合物,该化合物的结构式为 (3)元素X与元素T相比,非金属性较强的是元素T,下列表述中不能证明这一事实的选项是_ 。 a.常温下元素X的单质和元素T的单质的熔沸点不同 b.元素T的氢化物比元素X的氢化物稳定 c. 元素X和元素T的单质都能在氧气中燃烧 d.元素T最高价氧化物对应水化物的酸性比元素X最高价氧化物对应水化物的酸性强 e.Na2XO3溶液呈碱性,Na2TO4溶液呈中性 (4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中,化学性质明显不同于其他三种酸的是_______________(用化学式表示) |
|||||||||||
| 17. | 详细信息 | ||||||||||||||
|
(1)指出在使用下列仪器 (已净)或用品的第一步操作:
(2)配制一定物质的量浓度为0.4mol/LNaOH溶液500mL,填空并请回答下列问题:
用托盘天平称取固体样品时 (1g 以下使用游码),若将样品放在了天平的右盘,读数为10.5g,则所称样品的实际质量为 g。 (3)下列操作对配制的NaOH溶液浓度有偏低影响的是 。 A.称量时将NaOH固体直接放在天平托盘上面的纸上 B.将称量的NaOH固体置露在空气的时间过长 C.选用的容量瓶内有少量的蒸馏水 D.整个配制过程中容量瓶不振荡 E.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中 |
|||||||||||||||
| 18. | 详细信息 | |||
|
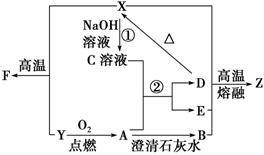
现有如图所示的转化关系,水和部分产物已略去。 已知:①X和Z是两种透明、不溶于水的坚硬固体,其中Z无固定熔点,是现代建筑不可缺少的装饰和采光材料;②无色气体A是引起温室效应的主要气体; ③B、D均为难溶于水的白色固体;④高纯度的F是使用最广泛的半导体材料。 据此回答下列问题: (1)Z的名称是________,工艺师在Z表面刻蚀花纹图案需用的试剂为________(填名称)。 (2)由X、Y制F的化学方程式为____________________________________________, 此反应中Y作________剂(填“氧化”或“还原”)。 (3)转化①的化学方程式为________________________________________________; 转化②(A少量)的离子方程式为___________________________________________。 |
||||
| 19. | 详细信息 |
|
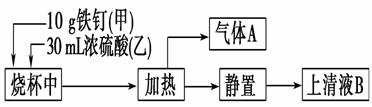
铁是生产生活中应用最广泛的一种金属。某化学学习小组在实验室中探究铁钉(主要成分为低碳钢)与热浓硫酸的反应。其探究流程如图所示:
(1)从实验安全的角度考虑,应先向烧杯中加入______(填“甲”或“乙”);根据加入的反应物的量,实验需要选取的烧杯的规格为________(填字母序号)。 a.50 mL b.100 mL c.500 mL d.1 000 mL (2)上清液B中可能既含Fe3+,又含Fe2+,要检验上清液B中有无Fe2+,应加入的试剂是________(填字母序号)。 a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.NaOH溶液 d.酸性KMnO4溶液 (3)气体A的主要成分是SO2,还可能含有H2和CO2。流程图中“加热”时可能生成CO2的原因是(用化学方程式表示)_____________________ ___________________________。 利用下列仪器可以同时检验气体A中是否含有H2和CO2(其中的夹持仪器、橡胶管和加热装置已经略去),则仪器的连接顺序是__________________________
D E F A B C D E F
已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色沉淀。 ②Y是红棕色的化合物。 反应Ⅰ的化学方程式为____________________________________________________ X通入BaCl2溶液,产生白色沉淀的化学式为 |
|
| 20. | 详细信息 |
|
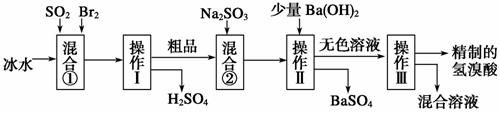
制的流程: 纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)常带有淡淡的黄色。于是甲、乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为________,若假设成立可观察到的现象为________。乙同学假设工业氢溴酸呈淡黄色是因为________,其用于证明该假设所用的试剂为_______。 |
|
| 21. | 详细信息 | |||||||||||||||
|
[化学-选修3:物质结构与性质](10分) 法医常用马氏试砷法检验是否砒霜(As2O3)中毒,涉及的反应如下: Ⅰ: 6Zn+As2O3+12HCl=6ZnCl2+2AsH3(砷烷) ↑+3H2O Ⅱ: 2AsH3=2As(黑色砷镜)+3H2 (1)写出砷的基态原子价电子排布式 (2)砷烷的空间结构为 ;砷烷中心原子杂化方式为 (3)砷烷同族同系列物质相关性质如下表:
从PH3 (4)第一电离能数据I(As) I(Se) (5)立方氮化硼(BN)是特殊的耐磨和切削材料,其晶胞结构与金刚石相似,如图所示。 晶胞有两个基本要素: 原子坐标参数,表示晶胞内部各原子的相对位置。如图b所示,其中原子坐标参数X为(0,0,0),Y原子的坐标参数为(1/2,0,1/2),则Z原子的坐标参数为________。 晶胞参数,描述晶胞的大小和形状。已知立方氮化硼的密度为d g∙cm-3,阿伏加德罗常数值为NA,则晶胞参数a=________nm。(列出计算式即可) |
||||||||||||||||
| 22. | 详细信息 |
|
[化学——选修5:有机化学基础](10分) 以苯和乙炔为原料合成化工原料E的路线如下:
回答下列问题: (1)A的名称 。 (2)生成B的化学方程式为 ,反应类型是 。 (3)C的结构简式为 ,C的分子中一定共面的碳原子最多有 个。 (4)与D同类别且有二个六元环结构(环与环之间用单键连接)的同分异构体有 种,请任写两种同分异构体的结构简式: 。 (5)参照上述合成路线,设计一条以乙炔和必要试剂合成环丙烷的路线: 。 |
|