2019йҮҚеәҶй«ҳдёҖдёӢеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–еӯҰеңЁеҸҜжҢҒз»ӯеҸ‘еұ•дёӯжӯЈеҸ‘жҢҘзқҖз§ҜжһҒзҡ„дҪңз”ЁгҖӮдёӢеҲ—еҒҡжі•дёҺеҸҜжҢҒз»ӯеҸ‘еұ•е®—ж—ЁзӣёиҝқиғҢзҡ„жҳҜ AпјҺжҺЁе№ҝзўіжҚ•йӣҶе’ҢеӯҳеӮЁжҠҖжңҜпјҢйҖҗжӯҘе®һзҺ°дәҢж°§еҢ–зўійӣ¶жҺ’ж”ҫвҖӮвҖӮвҖӮ BпјҺеҜ№е·Ҙдёҡеәҹж°ҙгҖҒз”ҹжҙ»жұЎж°ҙеҮҖеҢ–еӨ„зҗҶпјҢеҮҸе°‘жұЎжҹ“зү©зҡ„жҺ’ж”ҫвҖӮвҖӮвҖӮ CпјҺеҠ еӨ§еҢ–зҹізҮғж–ҷзҡ„ејҖйҮҮпјҢж»Ўи¶іж¶Ҳиҙ№йңҖжұӮвҖӮвҖӮвҖӮ DпјҺеҠ еӨ§жё…жҙҒиғҪжәҗзҡ„ејҖеҸ‘еҲ©з”ЁпјҢжҸҗй«ҳиө„жәҗзҡ„еҲ©з”ЁзҺҮвҖӮ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӯеӯҰеҢ–еӯҰдёӯеҫҲеӨҡвҖң规еҫӢвҖқйғҪжңүе…¶йҖӮз”ЁиҢғеӣҙпјҢдёӢеҲ—ж №жҚ®жңүе…івҖң规еҫӢвҖқжҺЁеҮәзҡ„з»“и®әеҗҲзҗҶзҡ„жҳҜ AпјҺеҚӨзҙ еҚ•иҙЁзҶ”зӮ№йҡҸж ёз”өиҚ·ж•°еўһеҠ иҖҢеҚҮй«ҳпјҢж•…жҺЁеҮәзўұйҮ‘еұһеҚ•иҙЁзҶ”зӮ№д№ҹйҡҸж ёз”өиҚ·ж•°еўһеҠ иҖҢеҚҮй«ҳ BпјҺSO2е’Ңж№ҝж¶Ұзҡ„Cl2йғҪжңүжјӮзҷҪжҖ§пјҢжҺЁеҮәдәҢиҖ…ж··еҗҲеҗҺжјӮзҷҪжҖ§жӣҙејәвҖӮ вҖӮвҖӮ CпјҺH2CO3зҡ„й…ёжҖ§жҜ”HClOејәпјҢжҺЁеҮәCO2йҖҡе…ҘNaClOжә¶ж¶ІдёӯиғҪз”ҹжҲҗHClOвҖӮ вҖӮвҖӮ DпјҺеёёжё©дёӢй“ңдёҺжө“зЎқй…ёеҸҜд»ҘеҲ¶еҸ–NO2пјҢжҺЁеҮәеёёжё©дёӢй“ҒдёҺжө“зЎқй…ёд№ҹеҸҜд»ҘеҲ¶еҸ–NO2вҖӮ
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іеҢ–еӯҰз”ЁиҜӯиЎЁзӨәжӯЈзЎ®зҡ„жҳҜ AпјҺж¬Ўж°Ҝй…ёзҡ„з»“жһ„ејҸпјҡHвҖ”ClвҖ”O
BпјҺ18O2п№Јзҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ CпјҺж°Ёж°”зҡ„з”өеӯҗејҸпјҡ DпјҺз”өеӯҗејҸиЎЁзӨәж°ҜеҢ–й’ зҡ„еҪўжҲҗиҝҮзЁӢпјҡ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
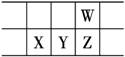
д»Ҡе№ҙжҳҜй—ЁжҚ·еҲ—еӨ«еҸ‘зҺ°е…ғзҙ е‘ЁжңҹеҫӢ150е‘Ёе№ҙгҖӮдёӢиЎЁжҳҜе…ғзҙ е‘ЁжңҹиЎЁзҡ„дёҖйғЁеҲҶпјҢWгҖҒXгҖҒYгҖҒZдёәзҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ пјҢWдёҺXзҡ„жңҖй«ҳеҢ–еҗҲд»·д№Ӣе’Ңдёә8гҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜВ В В В В В В В В В В В В В В
BпјҺеёёжё©еёёеҺӢдёӢпјҢYеҚ•иҙЁдёәеӣәжҖҒ CпјҺж°”жҖҒж°ўеҢ–зү©зғӯзЁіе®ҡжҖ§пјҡZ<W DпјҺXзҡ„жңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©жҳҜдёӨжҖ§ж°ўж°§еҢ–зү©
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҚеә”иҝҮзЁӢпјҢеҗҢж—¶жңүзҰ»еӯҗй”®гҖҒжһҒжҖ§е…ұд»·й”®е’ҢйқһжһҒжҖ§е…ұд»·й”®ж–ӯиЈӮе’ҢеҪўжҲҗзҡ„еҸҚеә”жҳҜ AпјҺNH4ClNH3вҶ‘+HClвҶ‘В BпјҺNH3+CO2+H2O===NH4HCO3 CпјҺ2NaOH+Cl2===NaCl+NaClO+H2OВ В В В В В DпјҺ2Na2O2+2CO2===2Na2CO3+O2
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҚеә”ж—ўеұһдәҺж°§еҢ–иҝҳеҺҹеҸҚеә”пјҢеҸҲеұһдәҺеҗёзғӯеҸҚеә”зҡ„жҳҜвҖӮвҖӮвҖӮ AпјҺй’ дёҺеҶ·ж°ҙзҡ„еҸҚеә”вҖӮвҖӮвҖӮвҖӮвҖӮвҖӮвҖӮвҖӮ BпјҺз”Ізғ·еңЁж°§ж°”дёӯзҡ„зҮғзғ§еҸҚеә”вҖӮвҖӮвҖӮ CпјҺзҒјзғӯзҡ„жңЁзӮӯдёҺCO2еҸҚеә”вҖӮвҖӮ DпјҺBa(OH)2В·8H2Oжҷ¶дҪ“дёҺNH4Clжҷ¶дҪ“зҡ„еҸҚеә”
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
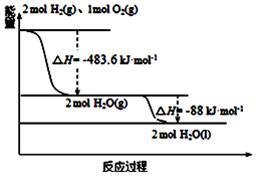
жҲ‘еӣҪй•ҝеҫҒзі»еҲ—иҝҗиҪҪзҒ«з®ӯдҪҝз”Ёзҡ„жҳҜд»Ҙж¶Іж°ўдёәзҮғзғ§еүӮпјҢж¶Іж°§дёәж°§еҢ–еүӮзҡ„й«ҳиғҪдҪҺжё©жҺЁиҝӣеүӮпјҢе·ІзҹҘпјҡ пјҲ1пјүH2пјҲgпјү===H2пјҲlпјүв–іH1=п№Ј0.92kJвҖўmolп№Ј1 пјҲ2пјүO2пјҲgпјү===O2пјҲlпјүв–іH2=п№Ј6.84kJвҖўmolп№Ј1 пјҲ3пјүеҰӮеӣҫпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ
AпјҺ2mol H2пјҲgпјүдёҺ1mol O2пјҲgпјүжүҖе…·жңүзҡ„жҖ»иғҪйҮҸжҜ”2molH2OпјҲgпјүжүҖе…·жңүзҡ„жҖ»иғҪйҮҸдҪҺ BпјҺж°ўж°”зҡ„зҮғзғ§зғӯдёәв–іH=п№Ј241.8 kJвҖўmolп№Ј1 CпјҺж¶Іж°ўзҮғзғ§зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸ2H2пјҲlпјү+O2пјҲlпјү===2H2OпјҲgпјүв–іH=п№Ј474.92kJвҖўmolп№Ј1 DпјҺH2OпјҲgпјүеҸҳжҲҗH2OпјҲlпјүзҡ„иҝҮзЁӢдёӯпјҢж–ӯй”®еҗёж”¶зҡ„иғҪйҮҸе°ҸдәҺжҲҗй”®ж”ҫеҮәзҡ„иғҪйҮҸ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
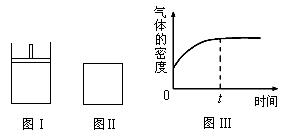
е°Ҷ4 mol Aж°”дҪ“е’Ң2 mol Bж°”дҪ“еңЁ2 Lзҡ„жҒ’е®№е®№еҷЁдёӯж··еҗҲпјҢ并еңЁдёҖе®ҡжқЎд»¶дёӢеҸ‘з”ҹеҰӮдёӢеҸҚеә”пјҡ2A(g)пјӢB(g) AпјҺз”Ёзү©иҙЁAиЎЁзӨә2sеҶ…зҡ„еҸҚеә”зҡ„е№іеқҮйҖҹзҺҮдёә0.3 molВ·LпјҚ1В·sпјҚ1 BпјҺ2 sж—¶е®№еҷЁеҶ…ж°”дҪ“еҺӢејәдёәиө·е§Ӣж—¶зҡ„0.8еҖҚ CпјҺ2 sж—¶зү©иҙЁAзҡ„иҪ¬еҢ–зҺҮдёә70% DпјҺ2 sж—¶зү©иҙЁBзҡ„жө“еәҰдёә0.6 molВ·LпјҚ1
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
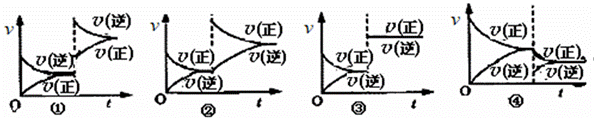
жҹҗжё©еәҰдёӢпјҢ2SO2(g) + O2(g)
AпјҺв‘ еӣҫеҸҜиғҪжҳҜеҠ еҺӢеј•иө·зҡ„ BпјҺв‘ЎеӣҫеҸҜиғҪжҳҜжҒ’еҺӢйҖҡO2еј•иө·зҡ„ CпјҺв‘ўеӣҫеҸҜиғҪжҳҜеҚҮй«ҳжё©еәҰеј•иө·зҡ„ DпјҺв‘ЈеӣҫжҳҜ移иө°йғЁеҲҶSO3еј•иө·зҡ„
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ҘдёҡдёҠеңЁжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯйҮҮз”ЁдёӢеҲ—еҸҚеә”еҗҲжҲҗз”ІйҶҮпјҡCO(g)+2H2(g) AпјҺa=1В В В b=2В В c=1BпјҺa=1В В В b=2В В c=5 CпјҺa=1В В В b=2В В c=7DпјҺa=1В В В b=2В В c=9
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜвҖӮ AпјҺжүҖжңүиҮӘеҸ‘иҝӣиЎҢзҡ„еҢ–еӯҰеҸҚеә”йғҪжҳҜж”ҫзғӯеҸҚеә”вҖӮвҖӮвҖӮвҖӮ BпјҺеҗҢдёҖзү©иҙЁеӣәгҖҒж¶ІгҖҒж°”дёүз§ҚзҠ¶жҖҒзҡ„зҶөеҖјзӣёеҗҢвҖӮвҖӮвҖӮвҖӮ CпјҺв–іH<0гҖҒв–іS>0зҡ„еҸҚеә”еҸҜиҮӘеҸ‘иҝӣиЎҢвҖӮ вҖӮвҖӮвҖӮ DпјҺеңЁе…¶д»–жқЎд»¶дёҚеҸҳзҡ„жғ…еҶөдёӢпјҢдҪҝз”ЁеӮ¬еҢ–еүӮеҸҜд»Ҙж”№еҸҳеҢ–еӯҰеҸҚеә”иҝӣиЎҢзҡ„ж–№еҗ‘
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
дёӢеҲ—е®һйӘҢж“ҚдҪңеҜ№еә”зҡ„е®һйӘҢзҺ°иұЎеҸҠи§ЈйҮҠжҲ–з»“и®әйғҪжӯЈзЎ®зҡ„жҳҜ
|
|||||||||||||||||||||
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
з”Іе®№еҷЁдёӯйҖҡе…Ҙ1 mol NO2 пјҢеҸҚеә”2NO2(g) AпјҺa>bВ В В В В В В В В BпјҺa<bВ В В В В В В В В CпјҺa=bВ В В В В В В В В DпјҺж— жі•зЎ®е®ҡ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёҖе®ҡжё©еәҰдёӢзҡ„еҜҶй—ӯе®№еҷЁдёӯпјҢеҸҚеә”2SO2(g) + O2(g) AпјҺvжӯЈ еўһеӨ§В В В В В В В В В В В В В В В В В BпјҺvйҖҶ еўһеӨ§В В В В В В В CпјҺSO2 зҡ„иҪ¬еҢ–зҺҮеҮҸе°ҸВ В В В В В В В В DпјҺSO3 зҡ„дә§зҺҮеўһеӨ§
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
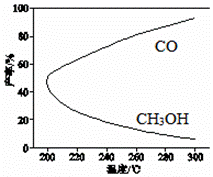
дёҖе®ҡжқЎд»¶дёӢпјҢеҲ©з”ЁCO2еҗҲжҲҗCH3OH зҡ„еҸҚеә”еҰӮдёӢпјҡCO2(g)+3H2(g) AпјҺв–іH1<0пјҢв–іH2>0 BпјҺеўһеӨ§еҺӢејәжңүеҲ©дәҺеҠ еҝ«еҗҲжҲҗеҸҚеә”зҡ„йҖҹзҺҮ CпјҺз”ҹдә§иҝҮзЁӢдёӯпјҢжё©еәҰи¶Ҡй«ҳи¶ҠжңүеҲ©дәҺжҸҗй«ҳCH3OH зҡ„дә§зҺҮ DпјҺеҗҲжҲҗCH3OHеҸҚеә”зҡ„е№іиЎЎеёёж•°иЎЁиҫҫејҸжҳҜK=
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
еҰӮдёӢеӣҫжүҖзӨәпјҢеӣҫв… жҳҜжҒ’еҺӢеҜҶй—ӯе®№еҷЁпјҢеӣҫв…ЎжҳҜжҒ’е®№еҜҶй—ӯе®№еҷЁгҖӮеҪ“е…¶е®ғжқЎд»¶зӣёеҗҢж—¶пјҢеңЁв… гҖҒв…ЎдёӯеҲҶеҲ«еҠ е…Ҙ2 mol Xе’Ң2 mol YпјҢејҖе§Ӣж—¶е®№еҷЁзҡ„дҪ“з§ҜеқҮдёәV LпјҢеҸ‘з”ҹеҰӮдёӢеҸҚеә” 2X(?)+Y(?)
AпјҺзү©иҙЁZзҡ„еҢ–еӯҰи®ЎйҮҸж•°a = 2 BпјҺиӢҘв…Ўдёӯж°”дҪ“зҡ„еҜҶеәҰеҰӮеӣҫв…ўжүҖзӨәпјҢеҲҷXгҖҒYдёӯеҸӘжңүдёҖз§Қдёәж°”жҖҒ CпјҺиӢҘXгҖҒYеқҮдёәж°”жҖҒпјҢеҲҷеңЁе№іиЎЎж—¶Xзҡ„иҪ¬еҢ–зҺҮпјҡв… п№Өв…Ў DпјҺиӢҘXдёәеӣәжҖҒгҖҒYдёәж°”жҖҒпјҢеҲҷв… гҖҒв…Ўдёӯд»ҺејҖе§ӢеҲ°е№іиЎЎжүҖйңҖзҡ„ж—¶й—ҙпјҡв… пјһв…Ў
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҲ13еҲҶпјүAгҖҒBгҖҒCгҖҒDгҖҒEгҖҒFдёәеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§зҡ„е…ӯз§Қзҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ пјҢAзҡ„дёҖз§Қж ёзҙ еҺҹеӯҗж ёдёӯеҸӘжңүиҙЁеӯҗпјҢжІЎжңүдёӯеӯҗгҖӮBзҡ„жңҖй«ҳд»·еҗ«ж°§й…ёдёҺе…¶ж°”жҖҒж°ўеҢ–зү©иғҪеҸ‘з”ҹеҢ–еҗҲеҸҚеә”пјҢCзҡ„жңҖеӨ–еұӮз”өеӯҗж•°жҳҜжүҖеңЁе‘Ёжңҹж•°зҡ„3еҖҚпјҢD+дёҺC2-е…·жңүзӣёеҗҢзҡ„з”өеӯҗж•°пјҢEжңҖй«ҳжӯЈд»·дёҺжңҖдҪҺиҙҹд»·д»Јж•°е’Ңдёә4гҖӮ пјҲ1пјүе·ІзҹҘASе…ғзҙ зҡ„еҺҹеӯҗеәҸж•°дёә33пјҢдёҺBеңЁеҗҢдёҖдё»ж—ҸпјҢAsеңЁе…ғзҙ е‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®гҖҖгҖҖгҖӮ пјҲ2пјүз”ұAгҖҒBгҖҒFдёүз§Қе…ғзҙ з»„жҲҗзӣҗзҡ„з”өеӯҗејҸдёәгҖҖгҖҖгҖӮ пјҲ3пјүCгҖҒDгҖҒEзҡ„зҰ»еӯҗеҚҠеҫ„з”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸдёәгҖҖгҖҖпјҲеЎ«зҰ»еӯҗз¬ҰеҸ·пјүгҖӮ пјҲ4пјүдёӢеҲ—дәӢе®һиғҪиҜҙжҳҺFе…ғзҙ зҡ„йқһйҮ‘еұһжҖ§жҜ”Eе…ғзҙ зҡ„йқһйҮ‘еұһжҖ§ејәзҡ„дҫқжҚ®жҳҜ_______(еЎ«еәҸеҸ·)гҖӮ aпјҺEе’ҢFдёӨе…ғзҙ зҡ„з®ҖеҚ•ж°ўеҢ–зү©еҸ—зғӯеҲҶи§ЈпјҢеҗҺиҖ…зҡ„еҲҶи§Јжё©еәҰй«ҳ bпјҺеңЁж°§еҢ–иҝҳеҺҹеҸҚеә”дёӯпјҢ1molFеҚ•иҙЁжҜ”1molEеҚ•иҙЁеҫ—з”өеӯҗеӨҡ cпјҺFзҡ„еҚ•иҙЁдёҺEзҡ„ж°ўеҢ–зү©ж°ҙжә¶ж¶ІеҸҚеә”пјҢжә¶ж¶ІеҸҳжө‘жөҠ пјҲ5пјүCдёҺDжҢүеҺҹеӯҗдёӘж•°1:1еҪўжҲҗзҡ„еҢ–еҗҲзү©пјҢеҗ«жңүзҡ„еҢ–еӯҰй”®зұ»еһӢдёәгҖҖгҖҖпјҢиҜҘеҢ–еҗҲзү©дёҺж°ҙеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҡгҖҖВ В гҖҖгҖӮ пјҲ6пјүCзҡ„ж°ўеҢ–зү©жІёзӮ№____Eзҡ„ж°ўеҢ–зү©жІёзӮ№пјҲеЎ«вҖңпјһвҖқпјҢвҖңпјңвҖқпјҢвҖңпјқвҖқпјү,еҺҹеӣ жҳҜгҖҖВ В гҖҖ гҖӮ
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||||||||||||||||||||||||||
|
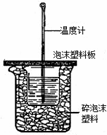
пјҲ1пјүд»Һе®һйӘҢиЈ…зҪ®дёҠзңӢпјҢеӣҫдёӯе°ҡзјәе°‘зҡ„дёҖз§Қд»ӘеҷЁжҳҜгҖҖВ гҖҖгҖӮеӨ§зғ§жқҜдёҠеҰӮдёҚзӣ–жіЎжІ«еЎ‘ж–ҷжқҝпјҢжұӮеҫ—зҡ„дёӯе’ҢзғӯгҖҖВ В гҖҖ-57.3kJ/molпјҲеЎ«вҖңпјһвҖқпјҢвҖңпјңвҖқпјҢвҖңпјқвҖқпјүгҖӮ в…ЎпјҺиҚүй…ёпјҲH2C2O4пјүжә¶ж¶ІдёҺй…ёжҖ§KMnO4жә¶ж¶ІеҸҚеә”ж—¶пјҢжә¶ж¶ІиӨӘиүІжҖ»жҳҜе…Ҳж…ўеҗҺеҝ«пјҢжҹҗеӯҰд№ е°Ҹз»„жҺўз©¶еҸҚеә”иҝҮзЁӢдёӯеҗҺйқўиӨӘиүІеҠ еҝ«зҡ„дё»иҰҒеҺҹеӣ пјҢиҝҮзЁӢеҰӮдёӢпјҡ гҖҗе®һйӘҢеҺҹзҗҶгҖ‘2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2вҶ‘ гҖҗжҸҗеҮәеҒҮи®ҫгҖ‘д»ҺеҪұе“ҚеҢ–еӯҰеҸҚеә”йҖҹзҺҮзҡ„еӣ зҙ пјҢзҢңжғіеҸҜиғҪзҡ„еҺҹеӣ пјҡ еҒҮи®ҫ1пјҡиҜҘеҸҚеә”жҳҜж”ҫзғӯеҸҚеә” еҒҮи®ҫ2пјҡеҸҚеә”з”ҹжҲҗзҡ„Mn2+еҜ№иҜҘеҸҚеә”жңүеӮ¬еҢ–дҪңз”Ё еҒҮи®ҫ3пјҡK+еҜ№иҜҘеҸҚеә”жңүеӮ¬еҢ–дҪңз”Ё пјҲ2пјүиҜҘе°Ҹз»„еҗҢеӯҰжңӘжҸҗеҮәжө“еәҰдҪҝеҸҚеә”йҖҹзҺҮеҠ еҝ«зҡ„еҒҮи®ҫпјҢеҺҹеӣ жҳҜгҖҖВ гҖҖгҖӮ гҖҗи®ҫи®ЎгҖҒе®ҢжҲҗе®һйӘҢгҖ‘ пјҲ3пјүе®ҢжҲҗжҺўз©¶пјҢи®°еҪ•ж•°жҚ®
е®һйӘҢйҮҮз”ЁжҺ§еҲ¶еҚ•дёҖеҸҳйҮҸзҡ„ж–№жі•пјҢеҲҶжһҗиЎЁдёӯж•°жҚ®еӣһзӯ”й—®йўҳпјҡ в‘ иЎЁж јдёӯxпјқгҖҖВ В гҖҖпјҢеҒҮи®ҫгҖҖВ В гҖҖжҲҗз«ӢгҖӮеҠ е…Ҙи’ёйҰҸж°ҙзҡ„зӣ®зҡ„жҳҜгҖҖВ гҖҖгҖӮ в‘Ўе®һйӘҢ b жөӢеҫ—ж··еҗҲеҗҺжә¶ж¶ІиӨӘиүІзҡ„ж—¶й—ҙдёә 15sпјҢеҝҪз•Ҙж··еҗҲеүҚеҗҺжә¶ж¶ІдҪ“з§Ҝзҡ„еҸҳеҢ–пјҢеҲҷиҝҷж®өж—¶й—ҙе№іеқҮеҸҚеә”йҖҹзҺҮ vпјҲKMnO4пјүпјқгҖҖ molвҖўL-1вҖўmin-1пјҲдҝқз•ҷ1дҪҚжңүж•Ҳж•°еӯ—пјүгҖӮ в‘ўиҜҘе°Ҹз»„еҗҢеӯҰи®ӨдёәдёҚе®ңз”Ё MnCl2 жә¶ж¶Ід»Јжӣҝ MnSO4 жә¶ж¶ІеҜ№иҜҘеҸҚеә”иҝӣиЎҢеӮ¬еҢ–жҺўз©¶пјҢе…¶еҺҹеӣ жҳҜ В В гҖҖпјҲз”ЁзҰ»еӯҗж–№зЁӢејҸиЎЁзӨәпјүгҖӮ
|
||||||||||||||||||||||||||||||||||||||||
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
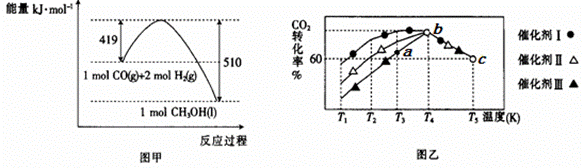
пјҲ13еҲҶпјүж°ўжҳҜдәә们公и®Өзҡ„жё…жҙҒиғҪжәҗпјҢж°ўзҡ„иҺ·еҫ—еҸҠд»Ҙж°ўдёәеҺҹж–ҷзҡ„е·Ҙдёҡз”ҹдә§е·ҘиүәжҲҗдёә科жҠҖе·ҘдҪңиҖ…з ”з©¶зҡ„йҮҚиҰҒиҜҫйўҳгҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүе·Ҙдёҡз”ҹдә§дёӯеҸҜеҲ©з”ЁH2иҝҳеҺҹCO2еҲ¶еӨҮжё…жҙҒиғҪжәҗз”ІйҶҮ(CH3OH)гҖӮ е·ІзҹҘCOпјҲgпјүе’ҢH2пјҲgпјүзҡ„зҮғзғ§зғӯеҲҶеҲ«дёә-283.0kJ/molгҖҒ-285.8kJ/molпјҢCOдёҺH2еҗҲжҲҗз”ІйҶҮзҡ„иғҪйҮҸеҰӮеӣҫз”ІжүҖзӨәпјҢеҲҷз”ЁCO2пјҲgпјүе’ҢH2пјҲgпјүеҲ¶еӨҮCH3OHпјҲlпјүзҡ„зғӯеҢ–еӯҰж–№зЁӢејҸдёәгҖҖВ гҖҖгҖӮ
В пјҲ2пјүдёҖе®ҡжқЎд»¶дёӢпјҢеҫҖ 2L жҒ’е®№еҜҶй—ӯе®№еҷЁдёӯе……е…Ҙ 1.0molCO2 е’Ң 3.0molH2еҸ‘з”ҹеҸҚеә”з”ҹжҲҗCH3OHпјҢеңЁдёҚеҗҢеӮ¬еҢ–еүӮдҪңз”ЁдёӢпјҢзӣёеҗҢж—¶й—ҙеҶ… CO2 зҡ„иҪ¬еҢ–зҺҮйҡҸжё©еәҰеҸҳеҢ–еҰӮеӣҫд№ҷжүҖзӨәпјҡ в‘ жё©еәҰдҪҺдәҺT4ж—¶еӮ¬еҢ–ж•ҲжһңжңҖеҘҪзҡ„жҳҜеӮ¬еҢ–еүӮгҖҖВ В гҖҖ пјҲ еЎ«вҖңIвҖқпјҢвҖңв…ЎвҖқпјҢвҖңв…ўвҖқпјүгҖӮ в‘ЎaзӮ№ vпјҲ жӯЈ пјүгҖҖВ В гҖҖvпјҲ йҖҶ пјү пјҲ еЎ«вҖңпјһвҖқпјҢвҖңпјңвҖқпјҢвҖңпјқвҖқпјүгҖӮи®Ўз®—cзӮ№ж—¶c(H2)=гҖҖВ В гҖҖпјҢеҸҚеә”иҫҫе№іиЎЎеҗҺе……е…Ҙ4molж°©ж°”пјҢH2зҡ„е№іиЎЎжө“еәҰгҖҖВ В гҖҖпјҲеЎ«вҖңеҸҳеӨ§вҖқпјҢвҖңеҸҳе°ҸвҖқпјҢвҖңдёҚеҸҳвҖқпјүгҖӮ в‘ўиҜҘеҸҚеә”еңЁ bзӮ№ж—¶е·Іиҫҫе№іиЎЎзҠ¶жҖҒпјҢbзӮ№зҡ„иҪ¬еҢ–зҺҮжҜ” c зӮ№й«ҳзҡ„еҺҹеӣ жҳҜгҖҖВ гҖҖгҖӮ в‘ЈеңЁжё©еәҰдёҚеҸҳзҡ„жқЎд»¶дёӢпјҢиҝӣдёҖжӯҘеҠ еҝ«еҸҚеә”йҖҹзҺҮ并жҸҗй«ҳH2иҪ¬еҢ–зҺҮзҡ„ж–№жі•жҳҜгҖҖВ В гҖҖпјҲеҶҷ1з§ҚпјүгҖӮ пјҲ3пјүеҲ©з”Ёеәҹејғзҡ„H2Sзҡ„зғӯеҲҶи§ЈеҸҜз”ҹдә§H2пјҡ2H2SпјҲgпјү
е·ІзҹҘпјҡKpдёәд»ҘеҲҶеҺӢиЎЁзӨәзҡ„е№іиЎЎеёёж•°пјҢеҲҶеҺӢпјқжҖ»еҺӢГ—зү©иҙЁзҡ„йҮҸеҲҶж•° жё©еәҰдёәT4в„ғж—¶пјҢиҜҘеҸҚеә”зҡ„е№іиЎЎеёёж•°KpпјқгҖҖгҖҖпјҲз”Ёеҗ«aзҡ„д»Јж•°ејҸиЎЁзӨәпјү
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||||||||||||||||||||
|
пјҲ13еҲҶпјүж°ЁеңЁз”ҹдә§гҖҒз§‘з ”дёӯз”ЁйҖ”е№ҝжіӣпјҢиҖҢNOxеҲҷеёҰжқҘдёҘйҮҚзҡ„зҺҜеўғжұЎжҹ“й—®йўҳгҖӮ пјҲ1пјүе·ІзҹҘеҸҚеә”зӣёе…іеҢ–еӯҰй”®й”®иғҪж•°жҚ®еҰӮдёӢпјҡ
з”ұжӯӨи®Ўз®—2NH3пјҲgпјү+3Cl2 пјҲgпјү===N2пјҲgпјү+6HClпјҲgпјүв–іHпјқгҖҖВ В гҖҖгҖӮ (2)зЎқй…ёй“өеҠ зғӯеҲҶи§ЈеҸҜеҫ—еҲ°N2Oе’ҢH2OгҖӮ250в„ғж—¶пјҢзЎқй…ёй“өеңЁеҜҶй—ӯе®№еҷЁдёӯеҲҶи§ЈиҫҫеҲ°е№іиЎЎпјҢиҜҘеҲҶи§ЈеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәгҖҖВ В гҖҖпјҢе№іиЎЎеёёж•°иЎЁиҫҫејҸдёәгҖҖгҖҖгҖӮ пјҲ3пјүз”Ёжҙ»жҖ§зӮӯиҝҳеҺҹжі•еҸҜд»ҘеӨ„зҗҶж°®ж°§еҢ–зү©пјҺжҹҗз ”з©¶е°Ҹз»„еҗ‘жҹҗеҜҶй—ӯе®№еҷЁдёӯеҠ е…Ҙи¶ійҮҸзҡ„жҙ»жҖ§зӮӯе’ҢNOпјҢеҸ‘з”ҹеҸҚеә”CпјҲsпјү+2NOпјҲgпјү
в‘ T1в„ғж—¶пјҢиҜҘеҸҚеә”зҡ„е№іиЎЎеёёж•°K=гҖҖВ В гҖҖгҖӮ в‘Ў30minеҗҺпјҢеҸӘж”№еҸҳжҹҗдёҖжқЎд»¶пјҢеҸҚеә”йҮҚж–°иҫҫеҲ°е№іиЎЎпјҢж №жҚ®дёҠиЎЁдёӯзҡ„ж•°жҚ®еҲӨж–ӯж”№еҸҳзҡ„жқЎд»¶еҸҜиғҪжҳҜ гҖҖВ В гҖҖпјҲеЎ«еӯ—жҜҚзј–еҸ·пјүгҖӮ aпјҺйҖӮеҪ“еҚҮй«ҳеҸҚеә”дҪ“зі»зҡ„жё©еәҰВ bпјҺйҖҡе…ҘдёҖе®ҡйҮҸзҡ„N2 cпјҺйҖӮеҪ“зј©е°Ҹе®№еҷЁзҡ„дҪ“з§ҜdпјҺеҠ е…ҘеҗҲйҖӮзҡ„еӮ¬еҢ–еүӮгҖҖгҖҖВ в‘ўеңЁжҒ’е®№жқЎд»¶дёӢпјҢиғҪеҲӨж–ӯиҜҘеҸҚеә”дёҖе®ҡиҫҫеҲ°еҢ–еӯҰе№іиЎЎзҠ¶жҖҒзҡ„дҫқжҚ®жҳҜгҖҖВ В гҖҖгҖҖпјҲеЎ«еӯ—жҜҚзј–еҸ·пјүгҖӮ aпјҺvжӯЈ(N2)= 2vйҖҶ(NO) bпјҺеҸҚеә”дҪ“зі»зҡ„еҺӢејәдёҚеҶҚеҸ‘з”ҹж”№еҸҳ cпјҺ dпјҺж··еҗҲж°”дҪ“зҡ„е№іеқҮзӣёеҜ№еҲҶеӯҗиҙЁйҮҸдҝқжҢҒдёҚеҸҳ eпјҺжҙ»жҖ§зӮӯзҡ„иҙЁйҮҸдёҚеҸҳ в‘ЈиӢҘдҝқжҢҒдёҺдёҠиҝ°еҸҚеә”еүҚ30minзҡ„еҸҚеә”жқЎд»¶дёҚеҸҳпјҢиө·е§Ӣж—¶NOзҡ„жө“еәҰдёә2.50mol/LпјҢеҲҷеҸҚеә”иҫҫе№іиЎЎж—¶cпјҲNOпјүпјқгҖҖВ В гҖҖгҖӮNOзҡ„иҪ¬еҢ–зҺҮгҖҖВ В гҖҖпјҲеЎ«вҖңеўһеӨ§вҖқгҖҒвҖңеҮҸе°ҸвҖқжҲ–вҖңдёҚеҸҳвҖқпјүгҖӮ
|
|||||||||||||||||||||||||||||||||||||||
- 2017-2018е№ҙеәҰй«ҳдёү第дёүж¬ЎиҒ”иҖғеҢ–еӯҰиҖғиҜ•пјҲе…ЁеӣҪеҗҚж ЎеӨ§иҒ”иҖғпјү
- 2017-2018е№ҙй«ҳдәҢдёҠеӯҰжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰиҖғйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲйҮҚеәҶеёӮ第дёҖдёӯеӯҰпјү
- 2017-2018е№ҙй«ҳдёҖдёҠеҚҠжңҹеҢ–еӯҰжңҹжң«иҖғиҜ•еңЁзәҝжөӢйӘҢпјҲж№–еҢ—зңҒе®ңжҳҢеёӮзӨәиҢғй«ҳдёӯеҚҸдҪңдҪ“пјү
- 2016-2017е№ҙй«ҳдёҖдёӢеӯҰжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰиҖғиҜ•йўҳпјҲдёҠжө·еёӮйҮ‘еұұдёӯеӯҰпјү
- й»„йҮ‘30йўҳзі»еҲ— й«ҳдәҢеҢ–еӯҰ еӨ§йўҳжҳ“дёўеҲҶ
- 2017-2018е№ҙй«ҳдёүеүҚеҚҠжңҹеҢ–еӯҰжңҹдёӯиҖғиҜ•еңЁзәҝжөӢйӘҢпјҲжІіеҚ—зңҒжҙӣйҳіеёӮпјү
- 2016-2017е№ҙй«ҳдёҖеҗҺеҚҠжңҹеҢ–еӯҰејҖеӯҰиҖғиҜ•еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§ЈжһҗпјҲзҰҸе»әзңҒеҺҰ门第дёҖдёӯеӯҰпјү
- иҲ’е…°еёӮ2019е№ҙй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҲиҖғжөӢйӘҢеҗҢжӯҘз»ғд№