2018高一上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
“秦砖汉瓦”是我国传统建筑文化的一个缩影。都是由黏土烧制的砖瓦,有的是黑色的,有的却是红色的,你猜测其中的原因可能 A.土壤中含有铁粉、二氧化锰等 B.黑砖瓦是煅烧过程中附着了炭黑,红砖则是添加了红色耐高温染料 C.土壤中含有的铜元素经过不同工艺煅烧,分别生成了黑色CuO和红色Cu D.土壤中含有的铁元素经过不同工艺煅烧,分别生成了黑色Fe3O4或FeO和红色Fe2O3
|
|
| 2. | 详细信息 |
|
我国科学家成功研制SiO2超分子纳米管,其微观结构如图,下列叙述不正确的是 A.该超分子性质稳定,不与任何酸发生反应 B.SiO2是酸性氧化物 C.SiO2在工业上可用于制造光导纤维 D.SiO2与碱的反应是非氧化还原反应
|
|
| 3. | 详细信息 |
|
下列反应中,调节反应条件以后,反应产物不会改变的是 A.钠与氧气 B.NaOH溶液和Al2(SO4)3溶液 C.盐酸与铁粉 D.二氧化碳与氢氧化钠溶液
|
|
| 4. | 详细信息 |
|
飞船内安装盛有Na2O2的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是 A.Na2O2中阴、阳离子的个数比为1∶1 B.Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等 C.Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等 D.Na2O2属于碱性氧化物
|
|
| 5. | 详细信息 |
|
下列反应的离子方程式书写不正确的是 A.硫酸与Na2SiO3溶液混合:SiO B.Cl2和NaOH溶液反应:Cl2+2OH-===Cl-+ClO-+H2O C.氯化铁溶液与铁反应: Fe3++Fe===2Fe2+ D.氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH-===Fe(OH)3↓
|
|
| 6. | 详细信息 |
|
下列说法不正确的是 A. SiO2可与HF反应,因而氢氟酸不能保存在玻璃瓶中 B. 可用石灰水区分Na2CO3与NaHCO3溶液 C.用加热法可除去Na2CO3中的NaHCO3 D.向氯水中滴加紫色石蕊溶液先变红后褪色
|
|
| 7. | 详细信息 |
|
若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能大量共存的是 A.NH C.Mg2+、SO
|
|
| 8. | 详细信息 |
|
有NaCl、MgCl 2 、FeCl 2 、FeCl 3 和AlCl 3 五种溶液,如用化学方法进行鉴别,只用一种试剂即可将它们鉴别开来,这种试剂是 A. 盐酸 B. AgNO 3 溶液 C.氨水 D. NaOH溶液
|
|
| 9. | 详细信息 |
|
有两份质量相同的NaHCO3,向第一份中加入盐酸使其充分反应;将第二份加热使其完全分解,冷却至原温度再加入相同浓度的盐酸,充分反应,则它们所耗用的盐酸的体积比为 A.2∶1 B.1∶1 C.1∶2 D.4∶1
|
|
| 10. | 详细信息 |
|
往100 mL 1 mol.L -1 的AlCl 3 溶液中滴加1 mol.L -1 的NaOH溶液,得3.9 g沉淀,则加入NaOH溶液的体积可能是 A. 100 mL B. 200 mL C. 300 mL D. 350 mL
|
|
| 11. | 详细信息 |
|
某溶液中有 Fe 3+、Mg 2+ 、Fe 2+ 和Al 3+ 四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量增加的阳离子是 A. Fe 3+ B. Mg 2+ C. Fe 2+ D. Al 3+
|
|
| 12. | 详细信息 |
|
两份铝屑,一份与足量的稀盐酸反应,另一份与足量的NaOH溶液反应,产生H2的体积比为1∶2(同温同压下),则两份铝屑的质量比为 A.1∶1 B.1∶2 C.1∶3 D.1∶4
|
|
| 13. | 详细信息 |
|
甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种。若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失。将丁溶液滴入甲溶液中时,无明显现象,据此可推断丙物质是 A.Al2 (SO4)3 B.FeSO4 C.NaOH D.BaCl2
|
|
| 14. | 详细信息 |
|
A. MgSO4 B. Al 2 (SO4 ) 3 C. Fe 2 (SO4 ) 3 D. NaAlO2
|
|
| 15. | 详细信息 |
|
如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时沉淀的物质的量y mol与加入NaOH溶液和盐酸的体积x mL的关系图,根据图示判断,下列结论中不正确的是 A.N点时溶液中的溶质只有NaCl B.原混合溶液中c (MgCl2)∶c (AlCl3)=1∶2 C.c (NaOH)=c (HCl) D.M点之前加入的是NaOH溶液,M点之后加入的是盐酸
|
|
| 16. | 详细信息 |
|
证明某溶液中只含有Fe2+而不含有Fe3+的实验方法是 ①先滴加氯水,再滴加KSCN溶液后显红色 ②先滴加KSCN溶液,不显红色,再滴加氯水后显红色 ③滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后呈红褐色 ④只需滴加KSCN溶液 A.①② B.②③ C.③④ D.①④
|
|
| 17. | 详细信息 |
|
0.6 mol·L-1的Fe2(SO4)3和1.2 mol·L-1的CuSO4的混合溶液200 mL,加入一定量铁粉充分反应后,测得溶液中Fe2+与Cu2+的物质的量之比为2∶1,则加入铁粉的物质的量为 A.0.16 mol B.0.22 mol C.0.30 mol D.0.48 mol
|
|
| 18. | 详细信息 | ||||||||||||||||||||
|
下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是
|
|||||||||||||||||||||
| 19. | 详细信息 |
|
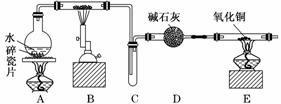
某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
(1)A装置的作用是________________________________________________________, B中反应的化学方程式为_______________________________________________。 (2)D的作用是____________________________________________________________。 (3)E中的现象是__________________________________________________________。 (4)A、B两个装置中应先点燃_______处的酒精灯,点燃E处酒精灯之前应进行的操作是_______________________________________________________________________。
|
|
| 20. | 详细信息 | ||
|
某研究性学习小组为研究氯气是否具有漂白性,设计如图所示实验装置。试根据实验装置回答下列问题: 多孔隔板 A、C中为干燥的有色布条,B为无色液体,D中为NaOH溶液。 (1)在常温下,KMnO4固体可以与浓盐酸反应生成氯气,其反应方程式为2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,则其反应装置应选用甲、乙、丙中的_ ________。 (2)B中的液体为____________,其作用为____________________________________。 (3)A、C中有色布条的颜色变化分别为__________________________________,A、C的实验现象说明氯气是否具有漂白性?________(填“是”或“否”)。 (4)D中NaOH溶液的作用是________________________________________(用离子方程式说明)。 (5)将产生的氯气通入滴有酚酞的NaOH溶液中,溶液红色褪去。小组内有甲、乙两种意见: 甲:氯气溶于水后溶液显酸性,中和了NaOH,使溶液褪为无色; 乙:氯气溶于水生成漂白性物质,使溶液褪为无色。 丙同学在褪色后的溶液中逐渐加入足量的NaOH溶液,溶液一直未见红色,则 _______(填“甲”或“乙”)的意见正确。
|
|||
| 21. | 详细信息 |
|
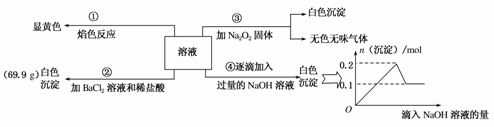
有一无色溶液100 mL,其中可能含有Fe3+、Al3+、Na+、Mg2+、Cu2+、NH
请回答下列问题: (1)焰色反应是________(填“物理”或“化学”)变化;实验②中经过滤得到白色沉淀,该沉淀如何洗涤?______________________________________________________________。 (2)原溶液中一定存在的离子有________(写化学式),可能存在的离子有________。 (3)实验③中产生的白色沉淀的成分可能是_________________________________。 (4)若溶液中K+物质的量为0.04 mol,则c(Na+)=________。
|
|