2019云南高一下学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
植物油和水、酒精和水、碘的饱和水溶液,这三组混合物的分离方法分别是( ) A. 过滤、蒸馏、分液 B. 分液、蒸馏、萃取 C. 萃取、蒸馏、过滤 D. 萃取、过滤、蒸馏
|
|
| 2. | 详细信息 |
|
化学试剂不变质和实验方法科学是化学实验成功的保障。下列试剂保存方法或实验方法中,不正确的是( ) A. 实验室中金属钠通常保存在煤油里 B. 液溴易挥发,在存放液溴的试剂瓶中应加水封 C. 保存FeCl3溶液时,通常在溶液中加少量的单质铁 D. 浓硝酸通常保存在棕色试剂瓶中,置于阴凉处
|
|
| 3. | 详细信息 |
|
胶体区别于其它分散系的本质是 A. 胶体分散质粒子直径在1 nm~100nm之间 B. 具有丁达尔现象 C. 胶体粒子不能穿过半透膜,能通过滤纸空隙 D. 胶体粒子在一定条件下能稳定存在
|
|
| 4. | 详细信息 |
|
下列溶液中,所给离子一定能大量共存的是( ) A. 含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl- B. 使酚酞变红的溶液:Na+、Ca2+、SO42-、CO32- C. 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- D. 含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
|
|
| 5. | 详细信息 |
|
检验Na2CO3溶液中是否混有Na2SO4,应使用的试剂是( ) A. BaCl2溶液和稀硫酸 B. BaCl2溶液 C. Ba(NO3)2溶液 D. BaCl2溶液和稀盐酸
|
|
| 6. | 详细信息 |
|
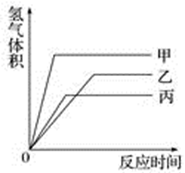
等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应后,都生成+2价的硫酸盐,其产生氢气的体积与反应时间的关系如图所示,则下列说法正确的是
A. 三种金属的活动性顺序为甲>乙>丙 B. 反应结束消耗硫酸的质量一定相同 C. 三种金属的相对原子质量是甲>乙>丙 D. 甲先反应完,乙最后反应完
|
|
| 7. | 详细信息 |
|
下列关于“金属材料”的叙述不正确是( ) A. 金属材料根据其组成可分为纯金属和合金 B. 密度大于4.5g·cm-3的金属称为重金属 C. 铁、铬、锰以及它们的合金称为黑色金属 D. 金属钠、镁、铝都是有色金属和重金属
|
|
| 8. | 详细信息 |
|
日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( ) A. 铜器出现铜绿[Cu2(OH)2CO3] B. 铁制菜刀生锈 C. 大理石雕像被酸性较强的雨腐蚀毁坏 D. 铝锅表面生成致密的薄膜(Al2O3)
|
|
| 9. | 详细信息 |
|
下列物质可用降温结晶法提纯的是( ) A. 食盐中混有少量泥沙 B. 含杂质氯化钠的硝酸钾 C. 氯化钠中含有杂质氯化镁 D. 酒精中混有少量的水
|
|
| 10. | 详细信息 |
|
在下列反应中,水既不是氧化剂,也不是还原剂的是 A. 2Na+2H20=2Na0H+H2↑ B. C12+H20=HC1+HC10 C. 2F2+2H20=4HF+02 D. 2H20
|
|
| 11. | 详细信息 |
|
在反应2SO2+O2 A. C.
|
|
| 12. | 详细信息 |
|
下列化学式只表示一种纯净物的是 A. C2H6 B. C4H10 C. C2H4Cl2 D. C
|
|
| 13. | 详细信息 |
|
蛋白质是人体必需的重要营养成分,下列食物中富含蛋白质的是( ) A. 白菜 B. 甘蔗 C. 豆腐 D. 牛油
|
|
| 14. | 详细信息 |
|
下列说法不正确的是( ) A. 金属元素的原子与非金属元素原子化合时都能形成离子键 B. 原子间通过得失电子变成阴、阳离子后,阴阳离子间才能形成离子键 C. 具有强得电子能力的原子与具有强失电子能力的原子相遇时能形成离子键 D. ⅠA、ⅡA族的金属和ⅥA、ⅦA族的非金属化合时,易形成离子键
|
|
| 15. | 详细信息 |
|
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
A. 反应CH4+H2O B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O C. 电池工作时,CO32-向电极B移动 D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
|
|
| 16. | 详细信息 |
|
在标准状态下,两种气态烷烃混合物的密度是1.16 g·L-1,此混合物组成不可能的是( ) A. 甲烷和乙烷 B. 乙烷和丙烷 C. 甲烷和丙烷 D. 甲烷和丁烷
|
|
| 17. | 详细信息 |
|
下列物质中,属于共价化合物的是( ) A. Cl2 B. NH4Cl C. C2H6 D. KOH
|
|
| 18. | 详细信息 |
|
下列关于苯的说法中,不正确的是( ) A. 苯不溶于水,可以作为萃取剂将溴从水中分离出来 B. 苯有毒,故不能作为有机溶剂 C. 苯是煤加工的产品之一 D. 苯是一种重要的化工原料
|
|
| 19. | 详细信息 |
|
下列物质是苯的同系物的是( ) A.
|
|
| 20. | 详细信息 |
|
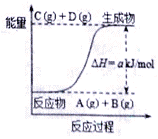
已知反应A+B
A. 产物C的能量高于反应物的总能量 B. 若该反应中有电子得失,则可设计成原电池 C. 反应物的总能量低于生成物的总能量 D. 该反应中的反应物A和B的转化率定相同
|
|
| 21. | 详细信息 |
|
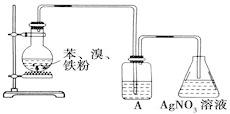
为了证明液溴与苯发生的反应是取代反应,有如图所示装置。则装置A中盛有的物质是
A. 水 B. NaOH溶液 C. CCl4 D. NaI溶液
|
|
| 22. | 详细信息 |
|
下列关于硅及其化合物 A. 硅晶体可用于制造光导纤维 B. 陶瓷、玻璃、水泥都是硅酸盐产品 C. 二氧化硅在电子工业中是重要的半导体材料 D. 二氧化硅与氢氟酸和氢氧化钠均能反应,属于两性氧化物
|
|
| 23. | 详细信息 |
|
乙烯的生产是衡量一个国家石油化工水平的重要标志。聚乙烯是以乙烯为原料合成的一种人们常用的高分子材料。下列有关聚乙烯的叙述中正确的是( )。 A. 乙烯合成聚乙烯的变化属于化合反应 B. 乙烯合成聚乙烯的化学方程式是nCH2=CH2 C. 聚乙烯在自然界中很难降解,容易导致“白色污染” D. 聚乙烯是纯净物
|
|
| 24. | 详细信息 |
|
能证明淀粉已部分水解的试剂是下列的( ) A. 淀粉碘化钾溶液 B. 银氨溶液、碘水、烧碱 C. 新制的氢氧化铜悬浊液 D. 碘水、稀硫酸
|
|
| 25. | 详细信息 |
|
下列对碱金属性质的叙述不正确的是( ) A. 单质都是银白色的柔软金属,密度都较小 B. 单质在空气中燃烧生成的都是过氧化物 C. 碱金属单质与水剧烈反应生成碱和氢气 D. 单质的熔沸点随着原子序数的增加而降低
|
|
| 26. | 详细信息 |
|
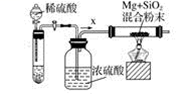
工业上通常利用SiO2和碳反应来制取硅,写出反应的化学方程式___________。工业上还可以利用镁制取硅,反应为2Mg+SiO2=2MgO+Si,同时会发生副反应:2Mg + Si=Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。 A.石灰石 B.锌粒 C.纯碱 (2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 _______________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。 (3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃。用化学方程式表示这两个反应①________________,②_________________。
|
|
| 27. | 详细信息 |
|
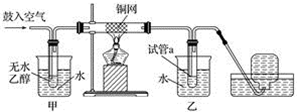
某实验小组用如图所示装置进行乙醇的催化氧化实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式________。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该反应是________反应(填“吸热”或“放热”)。 (2)甲和乙两个水浴作用不相同:甲的作用是________;乙的作用是________。 (3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是________________,集气瓶中收集到的主要成分是____________。
|
|
| 28. | 详细信息 | ||||
|
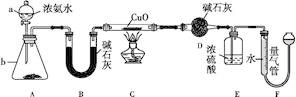
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1)仪器a的名称为 ;仪器b中可选择的试剂为 。 (2)实验室中,利用装置A,还可制取的无色气体是 (填字母)。
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体产生,上述现象证明NH3具有 性,写出相应的化学方程式: 。 (4)E装置中浓硫酸的作用是 。 (5)读取气体体积前,应对装置F进行的操作: 。 (6)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为 (用含m、n字母的代数式表示)。
|
|||||
| 29. | 详细信息 |
|
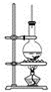
如图为硬脂酸甘油酯在碱性条件下水解的装置图。
进行皂化反应时的步骤如下: (1)在圆底烧瓶中加入8g硬脂酸甘油酯,然后加入2g氢氧化钠、5mL水和10mL酒精,加入酒精的作用为_____________________________________________。 (2)隔着石棉网给反应物加热约10min,皂化反应基本完成,判断依据是___________,所得的混合物为________(填“悬浊液”、“乳浊液”、“溶液”或“胶体”)。 (3)向所得混合物中加入__________,静置一段时间后,溶液分为上下两层,肥皂在____层,这个操作称为________。 (4)图中长玻璃导管的作用为______________________________________________________。 (5)日常生活中用热的纯碱溶液来洗涤粘有油脂的器皿的原因是________________________。 (6)这个实验有一个缺点就是容易产生________现象,为避免这种现象工业生产上常用________加热法防止这种现象。
|
|
| 30. | 详细信息 |
|
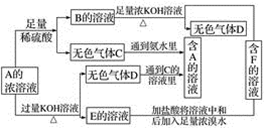
从物质A(某正盐)的水溶液出发有下面所示的一系列变化:
(1)写出A~F物质的化学式: A__________;B__________;C__________;D__________;E.__________;F__________。 (2)写出E→F的化学方程式______________________________。 (3)鉴别物质F中阴离子的方法是________________________。
|
|
| 31. | 详细信息 |
|
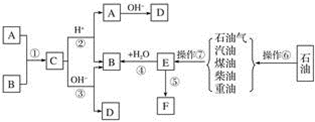
已知A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志,F是一种常见的高分子材料。根据下面转化关系回答下列问题:
(1)操作⑥、操作⑦的名称分别为________、________。 (2)下列物质中沸点最高的是________。 A 汽油 B 煤油 C 柴油 D 重油 (3)在①~⑤中属于取代反应的是________;原子利用率为100%的反应是________。(填序号) (4)写出结构简式:A________、F________。 (5)写出反应③的离子方程式:___________。 (6)作为家庭中常见的物质F,它给我们带来了极大的方便,同时也造成了环境污染,这种污染称为________。
|
|