山东高二上学期鲁科版高中化学月考试卷
| 1. | 详细信息 |
|
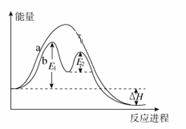
某反应过程能量变化如图所示,下列说法不正确的是( )
A.反应过程b有催化剂参与 B.该反应为放热反应,热效应等于ΔH C.改变催化剂,可改变该反应的活化能 D.有催化剂条件下,反应的活化能等于E1+E2
|
|
| 2. | 详细信息 |
|
对于:2C4H10(g)+13O2(g)===8CO2(g)+10H2O(l) ΔH=-5 800 kJ·mol-1的叙述错误的是 ( ) A. 该反应的反应热为-5 800 kJ·mol-1,是放热反应 B. 该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5 800 kJ·mol-1 C. 该反应的ΔH与各物质的状态有关,与化学计量数也有关 D. 该式的含义:25 ℃、101 kPa下,2 mol C4H10气体完全燃烧生成CO2和液态水时放出热量5 800 kJ
|
|
| 3. | 详细信息 |
|
往5mL 0.005 mol/L FeCl3溶液中滴加5mL 0.01 mol/L KSCN溶液,溶液呈红色,发生反应: FeCl3+3KSCN A.往上述溶液中加入饱和Fe2(SO4)3溶液,溶液红色变深 B.往上述溶液中加入KCl溶液,平衡向左移动 C.往上述溶液中加入铁粉,溶液红色变浅 D.往上述溶液中加入NaOH溶液,溶液变成红褐色
|
|
| 4. | 详细信息 |
|
合成氨所需的氢气可用煤和水作原料经过多步反应制得,其中的一步反应为: CO(g)+H2O(g) 反应到达平衡后,为提高CO的转化率,下列措施中正确的是 ( ) A.增加压强 B.降低温度 C.增大CO的浓度 D.更换催化剂
|
|
| 5. | 详细信息 |
|
密闭容器中发生反应:2X(g)+Y(s) A.减小容器体积,平衡正向移动 B.再加入Z,达平衡时Z的体积分数增大 C.再加入X,X的转化率减小 D.降低温度,Y的转化率增大
|
|
| 6. | 详细信息 |
|
恒温恒压下,对于反应:A(g)+3B(g) A. v正(A)= 3 v逆(C) B.密闭容器内气体的密度不再改变 C.单位时间内消耗3n mol C的同时,生成3n mol B D.密闭容器内气体的浓度之比为1:3:2
|
|
| 7. | 详细信息 |
|
生产水煤气的反应为:C(s)+H2O(g) = CO(g)+H2(g) △H = +131.4 kJ/mol 下列判断正确的是( ) A.反应物能量总和大于生成物能量总和 B.CO(g)+H2(g)= C(s)+H2O(l) △H = -131.4kJ/mol C.水煤气反应中生成1 mol H2(g)吸收131.4 KJ热量 D.水煤气反应中生成1体积CO(g)吸收131.4 KJ热量
|
|
| 8. | 详细信息 |
|
X(s)+3Y(g) A.10 s内,X的平均反应速率为0.025 mol·L-1·s-1 B.第10 s时,Y的反应速率为0.075 mol·L-1·s-1 C.第10 s时,X为1.5 mol,Y的浓度为0.25 mol·L-1 D.10 s内,X和Y反应放出的热量为a kJ
|
|
| 9. | 详细信息 |
|
下列说法不正确的是 ( ) A.反应混合物各组分的百分含量发生改变,化学平衡一定发生移动 B.化学平衡发生移动时,化学反应速率一定变化 C.平衡正向移动,反应物的转化率一定增大 D.外界条件发生变化,化学平衡不一定移动
|
|
| 10. | 详细信息 |
|
在容积一定的密闭容器中,反应:A(?)+B(g) A.正反应是放热反应 B.A不是气态物质,加入A该平衡向正反应方向移动 C.其他条件不变,降低温度该平衡向逆反应方向移动 D.改变压强对该平衡的移动无影响
|
|
| 11. | 详细信息 |
|
已知反应:2NO(g)+Br2(g) ① NO(g)+Br2(g) ② NO(g)+NOBr2(g) 下列有关该反应的说法正确的是 ( ) A.②的活化能比①的大 B.NOBr2是该反应的催化剂 C.逆反应的活化能比正反应的活化能小a kJ·mol-1 D.增大Br2(g)浓度能增大活化分子百分数,加快反应速率
|
|
| 12. | 详细信息 |
|
密闭容器中一定量混合气体发生反应:xA(g)+yB(g) A.x+y<z B.平衡向逆反应方向移动 C.C的体积分数降低 D.B的浓度增大
|
|
| 13. | 详细信息 |
|
已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=a kJ·mol-1 2C(s)+O2(g)===2CO(g) ΔH=-220 kJ·mol-1 H—H、O=O和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为( ) A.-332 B.-118 C.+130 D.+350 C . 一定条件下,通过下列反应可实现燃煤烟气中硫的回收: SO2(g)+2CO(g) 若反应在恒容的密闭容器中进行,下列有关说法正确的是 ( ) A.平衡前,随着反应的进行,容器内压强始终不变 B.平衡时,其它条件不变,分离出硫,正反应速率加快 C.平衡时,其他条件不变,升高温度可提高SO2的转化率 D.其它条件不变,使用不同催化剂,该反应的平衡常数不变
|
|
| 14. | 详细信息 |
|
一定温度下,在密闭容器中发生反应:N2O4(g) A.若增大容器的体积,则容器中气体的颜色先变浅后又变深,再次达平衡比原平衡颜色深 B.若压强不变,向容器中再加入一定量的N2O4,再次达到平衡时各物质的百分含量不变 C.若体积不变,向容器中再加入一定量的N2O4,相对于原平衡,平衡向正反应方向移动,再次平衡时N2O4的转化率减小 D.若体积不变,升高温度,再次平衡时体系颜色加深
|
|
| 15. | 详细信息 |
|
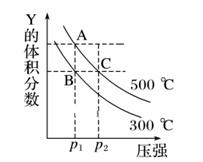
反应mX(g)
A.该反应的ΔH <0 B.m > n+p C.B、C两点化学平衡常数:KB<Kc D.A、B两点的反应速率v(A) > v(B)
|
|
| 16. | 详细信息 | ||||||||||||||||
|
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应:mX(g) ΔH=Q kJ·mol-1 反应达到平衡时,Y的物质的量浓度与温度、容器体积的关系如下表所示:
下列说法正确的是( ) A.增大压强,平衡正向移动 B.升高温度,该反应的平衡常数增大 C.温度不变,压强增大,Y的质量分数增大 D.体积不变,再加入Y ,Y的体积分数增大
|
|||||||||||||||||
| 17. | 详细信息 | ||||||||||||
|
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)
A.反应在前50 s 的平均速率v(PCl3)= 0. 0032 mol·L-1·s-1 B.保持其他条件不变,升高温度,平衡时c(PCl3)= 0. 11 mol·L-1,则反应的△H <0 C.相同温度下,起始时向容器中充入1. 0 mol PCl5、0. 20 mol PCl3 和0. 20 mol Cl2,反应达到 平衡前v(正)<v(逆) D. 相同温度下,起始时向容器中充入2. 0 mol PCl3 和2. 0 mol Cl2,达到平衡时,PCl3 的转化率大于80%
|
|||||||||||||
| 18. | 详细信息 | ||||||||||||
|
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下: ①CO(g)+2H2(g) ②CO2(g)+3H2(g) ③CO2(g)+H2(g) 回答下列问题: (1)已知反应①中的相关的化学键键能数据如下:
由此计算ΔH1=____________kJ.mol-1,已知 ΔH2=-58kJ.mol-1,则ΔH3=__________kJ.mol-1 (2)已知 CH3OH(g)+ 1/2 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ.mol-1 H2O(g)= H2O(l) ΔH=-44 kJ.mol-1 写出甲醇蒸气燃烧生成液态水的热化学方程式:____________________________________
|
|||||||||||||
| 19. | 详细信息 | ||||||||||||
|
已知A(g)+B(g)
回答下列问题: (1) 该反应的平衡常数表达式K= ,△H 0 (填“<” “ >” “ =”); (2) 830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡,A的转化率为________;保持温度不变,若向该密闭容器中再充入0.20mol的A和0.80mol的B,再达平衡时B的转化率为 ; (3) 1200℃时,反应C(g)+D(g)
|
|||||||||||||
| 20. | 详细信息 | ||||||||
|
已知反应2CH3OH(g)
(1)此时该反应__________(填“处于平衡状态”“向正反应方向进行”“向逆反应方向进行”) (2)平衡时,c(CH3OCH3) 为________________,CH3OH的转化率为___________(保留三位有效数字)。
|
|||||||||
| 21. | 详细信息 |
|
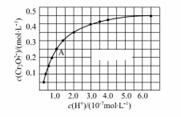
CrO42-和Cr2O72-在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示。
(1)用离子方程式表示Na2CrO4溶液中的转化反应___________________________________ (2) 由图可知,溶液酸性增大,Cr2O42-的平衡转化率 (填“增大“减小”或“不变”)。 根据A点数据,计算出该转化反应的平衡常数为 。 (3) 升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH 0(填“大于”“小于”或“等于”)。 (4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72-还原成Cr3+,该反应的离子方程式为_________________________________________________________________
|
|
| 22. | 详细信息 | |||||||||||||||||||||
|
(1)已知反应2HI(g)=H2(g) + I2(g) 的 △H = + 11 kJ·mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 KJ、151 KJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为 kJ。 (2)反应:2HI(g)
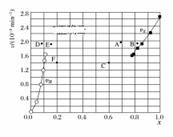
① 根据上述实验结果,该反应的平衡常数K的计算式为 。 ②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为 (以K和k正表示)。若k正=0.002 7 min-1,在t=40 min时,v正= min-1。 ③ 由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为 (填字母)。
|
||||||||||||||||||||||