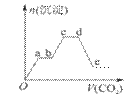2019е®үеҫҪй«ҳдәҢдёӢеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–еӯҰдёҺз”ҹдә§гҖҒз”ҹжҙ»еҜҶеҲҮзӣёе…іпјҢдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү A. жҷ¶дҪ“зЎ…жҳҜдёҖз§ҚдҝЎжҒҜжқҗж–ҷпјҢеёёз”ЁжқҘеҲ¶йҖ йӣҶжҲҗз”өи·ҜгҖҒе…үеҜјзәӨз»ҙ B. и‘Ўиҗ„й…’дёӯйҖҡеёёж·»еҠ е°‘йҮҸSO2пјҢж—ўеҸҜд»ҘжқҖиҸҢпјҢеҸҲеҸҜйҳІжӯўиҗҘе…»жҲҗеҲҶиў«ж°§еҢ– C. вҖңжҳҺеҰӮй•ңгҖҒеЈ°еҰӮзЈ¬вҖқзҡ„з“·еҷЁпјҢе…¶еҲ¶еҸ–еҺҹж–ҷдё»иҰҒдёәй»Ҹеңҹ D. з”Ёд№ҷйҶҡд»Һйқ’и’ҝдёӯжҸҗеҸ–йқ’и’ҝзҙ пјҢиҜҘиҝҮзЁӢеҢ…жӢ¬иҗғеҸ–ж“ҚдҪң
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е®һйӘҢж“ҚдҪңжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү A. з”ЁзЁҖзЎ«й…ёе’Ңй”ҢзІ’еҲ¶еҸ–H2ж—¶пјҢеҠ еҮ ж»ҙCu(NO3)2жә¶ж¶Ід»ҘеҠ еҝ«еҸҚеә”йҖҹзҺҮ B. еҗ‘Ca(ClO)2жә¶ж¶ІдёӯйҖҡе…ҘSO2ж°”дҪ“пјҢиҜҒжҳҺH2SO3зҡ„й…ёжҖ§ејәдәҺHClO C. з”Ёж ҮеҮҶHClжә¶ж¶Іж»ҙе®ҡNaHCO3жә¶ж¶ІжқҘжөӢе®ҡе…¶жө“еәҰпјҢйҖүжӢ©з”Іеҹәж©ҷдёәжҢҮзӨәеүӮ D. е°ҶCuдёҺжө“зЎ«й…ёеҸҚеә”еҗҺзҡ„ж··еҗҲзү©е…ҲеҶ·еҚҙпјҢеҶҚеҗ‘е…¶дёӯеҠ е…ҘеҶ·ж°ҙд»ҘйӘҢиҜҒз”ҹжҲҗзҡ„Cu2+
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
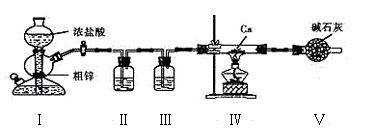
жҲ‘еӣҪ科еӯҰе®¶з ”еҲ¶еҮәзҡ„ж–°еһӢй«ҳж•Ҳе…үеӮ¬еҢ–еүӮиғҪеҲ©з”ЁеӨӘйҳіиғҪеҲҶи§Јж°ҙеҲ¶еҸ–ж°ўж°”пјҢдё»иҰҒиҝҮзЁӢеҰӮеӣҫжүҖзӨәпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү
A. дёҺз”өи§ЈзӣёжҜ”пјҢе…үи§Јж°ҙиҝҮзЁӢдёӯж¶ҲиҖ—зҡ„иғҪйҮҸиҫғдҪҺ B. иҝҮзЁӢIгҖҒв…ЎйғҪиҰҒеҗёж”¶иғҪйҮҸ C. иҝҮзЁӢв…Ўж—ўжңүжһҒжҖ§й”®еҪўжҲҗпјҢеҸҲжңүйқһжһҒжҖ§й”®еҪўжҲҗ D. еҲ©з”ЁиҶңеҲҶзҰ»жҠҖжңҜеҲҶзҰ»ж°ўж°”е’Ңж°§ж°”е…·жңүиүҜеҘҪзҡ„еә”з”ЁеүҚжҷҜ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAиЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү A. l molдёҷзғҜдёҺи¶ійҮҸзҡ„HClе®Ңе…ЁеҸҚеә”з”ҹжҲҗзҡ„CH3CH2CH2ClеҲҶеӯҗж•°дёәNA B. 1mol K2S2O8(Sе…ғзҙ C. еҗ«жңүNAдёӘFe(OH)3иғ¶зІ’зҡ„ж°ўж°§еҢ–й“Ғиғ¶дҪ“дёӯпјҢй“Ғе…ғзҙ зҡ„иҙЁйҮҸеӨ§дәҺ56 g D. 180gи‘Ўиҗ„зі–еҲҶеӯҗдёӯеҗ«жңүзҫҹеҹәж•°дёә6NA
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||||||||||||
|
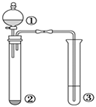
еҲ©з”ЁеҰӮеӣҫжүҖзӨәиЈ…зҪ®иҝӣиЎҢдёӢеҲ—е®һйӘҢпјҢиғҪеҫ—еҮәзӣёеә”е®һйӘҢз»“и®әзҡ„жҳҜпјҲВ В В пјү
A. AВ В В В В В В В В В В В В В В В В В B. BВ В В В В В В В В В В В В В В В В В C. CВ В В В В В В В В В В В В В В В В В D. D
|
||||||||||||||||||||||||||
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іиҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү A. иӢҜдёҺжө“HNO3е’Ңжө“H2SO4зҡ„ж··еҗҲж¶Іе…ұзғӯпјҢеҸ‘з”ҹеҸ–д»ЈеҸҚеә” B. д№ҷйҶҮеңЁдёҖе®ҡжқЎд»¶дёӢеҸҜд»ҘиҪ¬еҢ–дёәCO2жҲ–CH3COOC2H5 C. еҸҜд»Ҙз”Ёзўій…ёй’ жә¶ж¶ІеҢәеҲҶд№ҷй…ёгҖҒд№ҷйҶҮгҖҒиӢҜ D. д№ҷзғҜйҖҡе…Ҙжәҙж°ҙдёӯпјҢеҫ—еҲ°ж— иүІгҖҒеқҮдёҖжә¶ж¶І
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸд№ҰеҶҷжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү A. еҗ‘(NH4)2Fe(SO4)2жә¶ж¶ІдёӯеҠ иҝҮйҮҸNaOHжә¶ж¶ІпјҡNH4+пјӢFe2+пјӢ3OHпјҚ=Fe(OH)2вҶ“пјӢNH3вҖўH2O B. з”ЁзЁҖж°ўзўҳй…ёжә¶ж¶ІйҷӨеҺ»й“ҒеҲ¶е“ҒиЎЁйқўзҡ„й“Ғй”ҲпјҡFe2O3пјӢ6H+=2Fe3+пјӢ3H2O C. еҗ‘е°ҸиӢҸжү“жә¶ж¶ІдёӯеҠ е°‘йҮҸCa(OH)2жә¶ж¶ІпјҡCa2+пјӢ2OHпјҚпјӢ2HCO3-=CaCO3вҶ“пјӢ2H2OпјӢCO32- D. еҗ‘Ca(ClO)2жә¶ж¶Ідёӯж»ҙе…Ҙе°‘йҮҸNa2SO3жә¶ж¶ІпјҡClOпјҚпјӢSO32-=ClпјҚпјӢSO42-
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷи¶ійҮҸзҡ„CO2дёҚж–ӯйҖҡе…ҘKOHгҖҒBa(OH)2гҖҒKAlO2зҡ„ж··еҗҲжә¶ж¶ІдёӯпјҢз”ҹжҲҗжІүж·Җзҡ„зү©иҙЁзҡ„йҮҸдёҺжүҖйҖҡе…ҘCO2зҡ„дҪ“з§Ҝе…ізі»еҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—е…ідәҺж•ҙдёӘеҸҚеә”иҝҮзЁӢдёӯзҡ„иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲВ В В пјү
A. eзӮ№жә¶ж¶Ідёӯc(HCO3-)пјһc(K+) B. bcж®өеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜAlO2-пјӢ2H2OпјӢCO2=Al(OH)3вҶ“пјӢHCO3- C. dзӮ№жә¶ж¶Ідёӯc(K+)= c(H2CO3)пјӢc(HCO3-)пјӢc(CO32-) D. Oaж®өдёҺdeж®өжүҖж¶ҲиҖ—CO2зҡ„дҪ“з§ҜзӣёеҗҢ
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺжңүжңәеҢ–еҗҲзү©зҡ„иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲВ В В пјү A. е°јйҫҷз»ідё»иҰҒз”ұеҗҲжҲҗзәӨз»ҙеҲ¶йҖ B. и”—зі–зҡ„ж°ҙи§Јдә§зү©жңүдёӨз§ҚпјҢдё”дә’дёәеҗҢеҲҶејӮжһ„дҪ“ C. й«ҳзәӨз»ҙйЈҹзү©еҜҢеҗ«иҶійЈҹзәӨз»ҙзҡ„йЈҹзү©пјҢеңЁдәәдҪ“еҶ…йғҪеҸҜд»ҘйҖҡиҝҮж°ҙи§ЈеҸҚеә”жҸҗдҫӣиғҪйҮҸ D. еҠ зғӯиғҪеӨҹжқҖжӯ»жөҒж„ҹз—…жҜ’жҳҜеӣ дёәиӣӢзҷҪиҙЁеҸ—зғӯеҸҳжҖ§
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
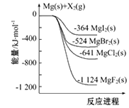
еҰӮеӣҫжҳҜйҮ‘еұһй•Ғе’ҢеҚӨзҙ еҚ•иҙЁ(X2)еҸҚеә”зҡ„иғҪйҮҸеҸҳеҢ–зӨәж„ҸеӣҫгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү
A. зғӯзЁіе®ҡжҖ§пјҡMgF2пјһMgCl2пјһMgBr2пјһMgI2 B. 22.4LF2(g)дёҺи¶ійҮҸзҡ„Mgе……еҲҶеҸҚеә”пјҢж”ҫзғӯ1124kJ C. е·ҘдёҡдёҠеҸҜз”ұз”өи§ЈMgCl2жә¶ж¶ІеҶ¶зӮјйҮ‘еұһMgпјҢиҜҘиҝҮзЁӢйңҖиҰҒеҗёж”¶зғӯйҮҸ D. з”ұеӣҫеҸҜзҹҘпјҡMgBr2(s)пјӢCl2(g)=MgCl2(s)пјӢBr2(l)В В вҲҶH=пјҚ117kJ/mol
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
зҺ°жңүWгҖҒXгҖҒYгҖҒZеқҮдёәзҹӯе‘Ёжңҹе…ғзҙ дё”еҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§пјҢе…ғзҙ Xе’ҢZеҗҢж—ҸгҖӮзӣҗYZWдёҺжө“зӣҗй…ёеҸҚеә”пјҢжңүй»„з»ҝиүІж°”дҪ“дә§з”ҹ,жӯӨж°”дҪ“еҗҢеҶ·зғ§зўұжә¶ж¶ІдҪңз”ЁпјҢеҸҜеҫ—еҲ°еҗ«YZWзҡ„жә¶ж¶ІгҖӮдёӢеҲ—й”ҷиҜҜзҡ„жҳҜпјҲВ В В пјү A. XдёҺZе…·жңүзӣёеҗҢзҡ„жңҖй«ҳеҢ–еҗҲд»·В В В В В В В В В В В В В В В В В B. Xе’ҢYеҪўжҲҗзҡ„еҢ–еҗҲзү©зҡ„ж°ҙжә¶ж¶Іе‘ҲзўұжҖ§ C. Yзҡ„ж°ўеҢ–зү©дёәзҰ»еӯҗеҢ–еҗҲзү©В В В В В В В В В В В В В В В В В В В В В D. з®ҖеҚ•зҰ»еӯҗеҚҠеҫ„пјҡYпјңXпјңW
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
гҖҠhem CommunгҖӢжҠҘеҜјпјҢMarcelВ MayorlеҗҲжҲҗзҡ„жЎҘиҝһеӨҡзҺҜзғғ( A. еұһдәҺйҘұе’ҢзғғпјҢеёёжё©ж—¶дёәж°”жҖҒВ В В В В В В В В В В В В В В В В В B. дәҢж°Ҝд»Јзү©е…ұжңү5з§Қ C. еҲҶеӯҗдёӯеҗ«жңү4дёӘдә”е…ғзҺҜВ В В В В В В В В В В В В В В В В В В В В В В D. дёҚеӯҳеңЁеұһдәҺиӢҜзҡ„еҗҢзі»зү©зҡ„еҗҢеҲҶејӮжһ„дҪ“
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҖз§Қеәҹж–ҷзҡ„дё»иҰҒжҲҗеҲҶжҳҜй“Ғй•ҚеҗҲйҮ‘пјҢиҝҳеҗ«жңүй“ңгҖҒй’ҷгҖҒй•ҒгҖҒзЎ…зҡ„ж°§еҢ–зү©пјҢз”ұиҜҘеәҹж–ҷеҲ¶еӨҮзҡ„зәҜеәҰиҫғй«ҳзҡ„ж°ўж°§еҢ–й•ҚпјҢе·ҘиүәжөҒзЁӢеҰӮдёӢпјҢе·ІзҹҘеёёжё©дёӢKsp[Ni(OH)2]=1.0Г—10-15пјҢеҲҷдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲВ В В пјү
A. еәҹжёЈдёӯеҗ«жңүдәҢж°§еҢ–зЎ…е’ҢзЎ«й…ёй’ҷ B. еҠ зғӯз…®жІёеҸҜд»ҘжҸҗй«ҳйҷӨй“Ғж•ҲзҺҮ C. йҷӨй“ңиҝҮзЁӢдёӯпјҢжә¶ж¶Ій…ёжҖ§еўһејә D. вҖңжІүй•ҚвҖқиҝҮзЁӢдёӯдёәдәҶе°Ҷй•ҚжІүж·Җе®Ңе…ЁпјҢйңҖиҰҒи°ғиҠӮpHпјһ9
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
ж°ўеҢ–й’ҷ(CaH2)еёёдҪңдҫӣж°ўеүӮпјҢйҒҮж°ҙи’ёж°”еү§зғҲеҸҚеә”гҖӮжҹҗе°Ҹз»„и®ҫи®ЎеҰӮдёӢе®һйӘҢеҲ¶еӨҮж°ўеҢ–й’ҷгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲВ В В пјү
A. иЈ…зҪ®IдёҚеҸҜз”ЁдәҺдәҢж°§еҢ–й”°дёҺжө“зӣҗй…ёеҸҚеә”еҲ¶еҸ–ж°Ҝж°” B. иЈ…зҪ®IIIгҖҒVжүҖиө·дҪңз”ЁзӣёеҗҢ C. зӣҙзҺ»з’ғз®ЎеҠ зғӯеүҚпјҢз”ЁиҜ•з®ЎеңЁжң«з«Ҝ收йӣҶж°”дҪ“并йӘҢзәҜ D. иҜ•йӘҢз»“жқҹеҗҺпјҢеҸҜйҖҡиҝҮеҸ–ж ·еҠ ж°ҙпјҢж №жҚ®ж°”жіЎеҲӨж–ӯжҳҜеҗҰжңүCaH2з”ҹжҲҗ
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
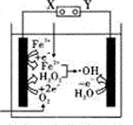
з”өвҖ”Fentonжі•жҳҜз”ЁдәҺж°ҙдҪ“йҮҢжңүжңәжұЎжҹ“зү©йҷҚи§Јзҡ„й«ҳзә§ж°§еҢ–жҠҖжңҜпјҢе…¶еҸҚеә”еҺҹзҗҶеҰӮеӣҫжүҖзӨәпјҢе…¶дёӯз”өи§Јдә§з”ҹзҡ„H2O2дёҺFe2+еҸ‘з”ҹFentonеҸҚеә”пјҢFe2+пјӢH2O2=Fe3+пјӢOHпјҚпјӢвҖўOHпјҢз”ҹжҲҗзҡ„зғғеҹәиҮӘз”ұеҹә(вҖўOH)иғҪж°§еҢ–йҷҚи§ЈжңүжңәжұЎжҹ“зү©гҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү
A. з”өи§Јжұ е·Ұиҫ№з”өжһҒзҡ„з”өеҠҝжҜ”еҸіиҫ№з”өжһҒзҡ„з”өеҠҝй«ҳ B. з”өи§Јжұ дёӯеҸӘжңүO2е’ҢFe3+еҸ‘з”ҹиҝҳеҺҹеҸҚеә” C. ж¶ҲиҖ—1 molO2пјҢз”өи§Јжұ еҸіиҫ№з”өжһҒдә§з”ҹ4mol вҖўOH D. з”өи§Јжұ е·ҘдҪңж—¶пјҢеҸіиҫ№з”өжһҒйҷ„иҝ‘жә¶ж¶Ізҡ„pHеўһеӨ§
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
еёёжё©пјҢеҗ‘20 ml0.1mol/Lзҡ„CH3COOHжә¶ж¶Ідёӯж»ҙеҠ зӯүжө“еәҰзҡ„NaOHжә¶ж¶ІпјҢе·ІзҹҘз”ұж°ҙз”өзҰ»еҮәзҡ„ж°ўж°§ж №зҰ»еӯҗжө“еәҰcж°ҙ(OHпјҚ)йҡҸж»ҙе…Ҙзҡ„NaOHжә¶ж¶Ізҡ„дҪ“з§ҜеҸҳеҢ–еҰӮеӣҫжүҖзӨәпјҢдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲВ В В пјү
A. еёёжё©дёӢпјҢйҶӢй…ёзҡ„з”өзҰ»еёёж•°зәҰдёә1Г—10-5 B. bгҖҒdдёӨзӮ№жә¶ж¶ІдёӯеқҮеӯҳеңЁc(Na+)=c(CH3COOпјҚ) C. V1=20 D. cзӮ№жә¶ж¶Іеӯҳ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
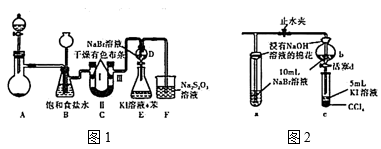
ж°Ҝе…ғзҙ зҡ„еҚ•иҙЁеҸҠе…¶еҢ–еҗҲзү©з”ЁйҖ”е№ҝжіӣгҖӮжҹҗе…ҙи¶Је°Ҹз»„жӢҹеҲ¶еӨҮж°Ҝ气并йӘҢиҜҒе…¶дёҖзі»еҲ—жҖ§иҙЁгҖӮ IпјҺгҖҗжҹҘйҳ…иө„ж–ҷгҖ‘ в‘ еҪ“жәҙж°ҙжө“еәҰиҫғе°Ҹж—¶пјҢжә¶ж¶ІйўңиүІдёҺж°Ҝж°ҙзӣёдјјд№ҹе‘Ҳй»„иүІ в‘ЎзЎ«д»ЈзЎ«й…ёй’ (Na2S2O3)жә¶ж¶ІеңЁе·ҘдёҡдёҠеҸҜдҪңдёәи„ұж°ҜеүӮ IIпјҺгҖҗжҖ§иҙЁйӘҢиҜҒгҖ‘ е®һйӘҢиЈ…зҪ®еҰӮеӣҫ1жүҖзӨә(зңҒз•ҘеӨ№жҢҒиЈ…зҪ®)
пјҲ1пјүиЈ…зҪ®Aдёӯзӣӣж”ҫеӣәдҪ“иҜ•еүӮзҡ„д»ӘеҷЁжҳҜ____пјӣиӢҘеҲҶеҲ«з”ЁKMnO4гҖҒCa(ClO)2гҖҒKClO3еӣәдҪ“дёҺи¶ійҮҸзҡ„жө“зӣҗй…ёеҸҚеә”пјҢеҲҷдә§з”ҹзӯүйҮҸж°Ҝж°”иҪ¬з§»зҡ„з”өеӯҗж•°д№ӢжҜ”дёә____гҖӮ пјҲ2пјүиЈ…зҪ®CдёӯIIеӨ„жүҖеҠ зҡ„иҜ•еүӮеҸҜд»ҘжҳҜ____(еЎ«дёӢеҲ—еӯ—жҜҚзј–еҸ·) AпјҺзўұзҹізҒ°В В В В BпјҺжө“зЎ«й…ёВ В В В В В CпјҺзЎ…й…ёВ В В В В В DпјҺж— ж°ҙж°ҜеҢ–й’ҷ пјҲ3пјүиЈ…зҪ®Bзҡ„дҪңз”ЁжңүпјҡйҷӨеҺ»ж°Ҝж°”дёӯзҡ„ж°ҜеҢ–ж°ўгҖҒ______гҖҒ_____гҖӮ пјҲ4пјүдёҚиҖғиҷ‘Br2зҡ„жҢҘеҸ‘пјҢжЈҖйӘҢFжә¶ж¶ІдёӯCl-йңҖиҰҒзҡ„иҜ•еүӮжңү_______гҖӮ IIIпјҺгҖҗжҺўз©¶е’ҢеҸҚжҖқгҖ‘ еӣҫдёҖдёӯи®ҫи®ЎиЈ…зҪ®DгҖҒEзҡ„зӣ®зҡ„жҳҜжҜ”иҫғж°ҜгҖҒжәҙгҖҒзўҳзҡ„йқһйҮ‘еұһжҖ§пјҢжңүеҗҢеӯҰи®ӨдёәиҜҘи®ҫи®ЎдёҚиғҪиҫҫеҲ°е®һйӘҢзӣ®зҡ„гҖӮиҜҘз»„зҡ„еҗҢеӯҰжҖқиҖғеҗҺе°ҶдёҠиҝ°DгҖҒEгҖҒFиЈ…зҪ®ж”№дёәеӣҫ2иЈ…зҪ®пјҢе®һйӘҢж“ҚдҪңжӯҘйӘӨеҰӮдёӢпјҡ в‘ жү“ејҖжӯўж°ҙеӨ№пјҢзј“зј“йҖҡе…Ҙж°Ҝж°”пјӣв‘ЎеҪ“aе’Ңbдёӯзҡ„жә¶ж¶ІйғҪеҸҳдёәй»„иүІж—¶пјҢеӨ№зҙ§жӯўж°ҙеӨ№пјӣ в‘ўеҪ“aдёӯжә¶ж¶Із”ұй»„иүІеҸҳдёәжЈ•иүІж—¶пјҢеҒңжӯўйҖҡж°Ҝж°”пјӣв‘ЈвҖҰ пјҲ5пјүи®ҫи®ЎжӯҘйӘӨв‘ўзҡ„зӣ®зҡ„жҳҜ______гҖӮ пјҲ6пјүиҝҳиғҪдҪңдёәж°ҜгҖҒжәҙгҖҒзўҳйқһйҮ‘еұһжҖ§йҖ’еҸҳ规еҫӢеҲӨж–ӯдҫқжҚ®зҡ„жҳҜ_____(еЎ«дёӢеҲ—еӯ—жҜҚзј–еҸ·) AпјҺCl2гҖҒBr2гҖҒI2зҡ„зҶ”зӮ№В В В В В В В В В В В В В В В В BпјҺHClгҖҒHBrгҖҒHIзҡ„й…ёжҖ§ CпјҺHClгҖҒHBrгҖҒHIзҡ„зғӯзЁіе®ҡжҖ§В В В В В В В В В В DпјҺHClгҖҒHBrгҖҒHIзҡ„иҝҳеҺҹжҖ§
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
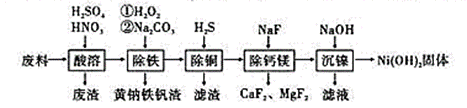
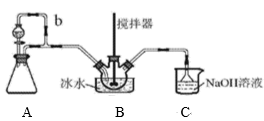
дәҡзЎқй…°зЎ«й…ё(NOSO4H)дё»иҰҒз”ЁдәҺжҹ“ж–ҷгҖҒеҢ»иҚҜзӯүе·ҘдёҡгҖӮе®һйӘҢе®Өз”ЁеҰӮеӣҫиЈ…зҪ®(еӨ№жҢҒиЈ…зҪ®з•Ҙ)еҲ¶еҸ–е°‘йҮҸзҡ„NOSO4HпјҢ并жЈҖйӘҢдә§е“ҒзәҜеәҰгҖӮе·ІзҹҘпјҡNOSO4HйҒҮж°ҙж°ҙи§ЈпјҢдҪҶжә¶дәҺжө“зЎ«й…ёиҖҢдёҚеҲҶи§ЈгҖӮ
пјҲ1пјүеҲ©з”ЁиЈ…зҪ®AеҲ¶еҸ–SO2пјҢдёӢеҲ—жңҖйҖӮе®ңзҡ„иҜ•еүӮжҳҜ_____(еЎ«дёӢеҲ—еӯ—жҜҚзј–еҸ·) AпјҺNa2SO3еӣәдҪ“е’Ң20%зЎқй…ёВ В В В В В В В В В BпјҺNa2SO3еӣәдҪ“е’Ң20%зЎ«й…ё CпјҺNa2SO3еӣәдҪ“е’Ң70%зЎ«й…ёВ В В В В В В В В В DпјҺNa2SO3еӣәдҪ“е’Ң18.4mol/LзЎ«й…ё пјҲ2пјүиЈ…зҪ®Bдёӯжө“HNO3е’ҢSO2еңЁжө“H2SO4дҪңз”ЁдёӢеҸҚеә”еҲ¶еҫ—NOSO4HгҖӮ в‘ дёәдәҶжҺ§еҲ¶йҖҡе…ҘSO2зҡ„йҖҹзҺҮпјҢеҸҜд»ҘйҮҮеҸ–зҡ„жҺӘж–ҪжҳҜ_______гҖӮ в‘ЎиҜҘеҸҚеә”еҝ…йЎ»з»ҙжҢҒдҪ“зі»жё©еәҰдёҚдҪҺдәҺ20в„ғгҖӮиӢҘжё©еәҰиҝҮй«ҳпјҢдә§зҺҮйҷҚдҪҺзҡ„еҸҜиғҪеҺҹеӣ жҳҜ____гҖӮ в‘ўејҖе§ӢеҸҚеә”зј“ж…ўпјҢеҫ…з”ҹжҲҗе°‘йҮҸNOSO4HеҗҺпјҢжё©еәҰеҸҳеҢ–дёҚеӨ§пјҢдҪҶеҸҚеә”йҖҹзҺҮжҳҺжҳҫеҠ еҝ«пјҢе…¶еҺҹеӣ еҸҜиғҪжҳҜ______гҖӮ пјҲ3пјүеңЁе®һйӘҢиЈ…зҪ®еӯҳеңЁеҸҜиғҪеҜјиҮҙNOSO4Hдә§йҮҸйҷҚдҪҺзҡ„зјәйҷ·жҳҜ______гҖӮ пјҲ4пјүжөӢе®ҡNOSO4Hзҡ„зәҜеәҰ еҮҶзЎ®з§°еҸ–1.337 gдә§е“ҒеҠ е…Ҙ250 mLзўҳйҮҸ瓶дёӯпјҢеҠ е…Ҙ0.1000mol/LгҖҒ60.00 mLзҡ„KMnO4ж ҮеҮҶжә¶ж¶Іе’Ң10 mL 25%H2SO4жә¶ж¶ІпјҢ然еҗҺж‘ҮеҢҖгҖӮз”Ё0.2500 mol/LиҚүй…ёй’ ж ҮеҮҶжә¶ж¶Іж»ҙе®ҡпјҢж¶ҲиҖ—иҚүй…ёй’ жә¶ж¶Ізҡ„дҪ“з§Ҝдёә20.00 mLгҖӮ е·ІзҹҘпјҡ2KMnO4пјӢ5NOSO4HпјӢ2H2OпјқK2SO4пјӢ2MnSO4пјӢ5HNO3пјӢ2H2SO4 в‘ й…Қе№іпјҡ__MnO4-пјӢ___C2O42-пјӢ______пјқ___Mn2+пјӢ____пјӢ__H2O в‘ЎдәҡзЎқй…°зЎ«й…ёзҡ„зәҜеәҰ=___%(и®Ўз®—з»“жһңдҝқз•ҷдёӨдҪҚжңүж•Ҳж•°еӯ—)гҖӮ
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
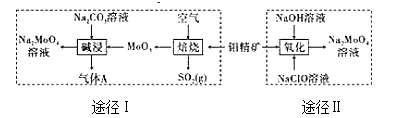
й’јй…ёй’ жҷ¶дҪ“(Na2MoO4вҖў2H2O)жҳҜдёҖз§Қж— е…¬е®іеһӢеҶ·еҚҙж°ҙзі»з»ҹзҡ„йҮ‘еұһзј“иҡҖеүӮгҖӮе·ҘдёҡдёҠеҲ©з”Ёй’јзІҫзҹҝ(дё»иҰҒжҲҗеҲҶжҳҜдёҚжә¶дәҺж°ҙзҡ„MoS2)еҲ¶еӨҮй’јй…ёй’ зҡ„дёӨз§ҚйҖ”еҫ„еҰӮеӣҫжүҖзӨәпјҡ
пјҲ1пјүйҖ”еҫ„в… иҝҳеҺҹеүӮдёҺж°§еҢ–еүӮзү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә(дёҚиҖғиҷ‘жқӮиҙЁзҡ„еҸҚеә”)_____пјӣзўұжөёж—¶ж°”дҪ“Aзҡ„з”өеӯҗејҸдёә_______гҖӮ пјҲ2пјүйҖ”еҫ„IIж°§еҢ–ж—¶жә¶ж¶ІдёӯиҝҳжңүNa2SO4з”ҹжҲҗпјҢеҲҷеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә____гҖӮ пјҲ3пјүе·ІзҹҘйҖ”еҫ„Iзҡ„й’јй…ёй’ жә¶ж¶Ідёӯc(MoO42-)=0.40 mol/LпјҢc(CO32-)=0.40mol/LгҖӮз”ұй’јй…ёй’ жә¶ж¶ІеҲ¶еӨҮй’јй…ёй’ жҷ¶дҪ“ж—¶пјҢйңҖеҠ е…ҘBa(OH)2еӣәдҪ“д»ҘйҷӨеҺ»CO32-гҖӮеҪ“CO32-зҡ„йҷӨеҺ»зҺҮдёә90%ж—¶пјҢеҲ—ејҸи®Ўз®—жӯӨж—¶жҳҜеҗҰжңүBaMoO4жІүж·Җз”ҹжҲҗ____гҖӮ[е·ІзҹҘKsp(BaCO3)=1Г—10-9гҖҒKsp(BaMoO4)=4.0Г—10-8пјҢеҝҪз•Ҙжә¶ж¶Ізҡ„дҪ“з§ҜеҸҳеҢ–] пјҲ4пјүйҖ”еҫ„IIжүҖеҫ—зҡ„BaMoO4жә¶ж¶Із»“жҷ¶еҗҺеҶҚз»ҸиҝҮйҮҚз»“жҷ¶еҸҜдҪҝй’јй…ёй’ жҷ¶дҪ“зҡ„зәҜеәҰжҸҗй«ҳпјҢе…¶еҲ©з”Ёзҡ„еҺҹзҗҶжҳҜ_____гҖӮ пјҲ5пјүжҹҗй”Ӯз”өжұ ж”ҫз”өиҝҮзЁӢдёӯпјҢз”өжһҒдёҠеҸ‘з”ҹLix(MoS2)nдёҺMoS2д№Ӣй—ҙзҡ„иҪ¬еҢ–гҖӮеҲҷз”өжұ ж”ҫз”өж—¶жӯЈжһҒзҡ„з”өжһҒеҸҚеә”ејҸдёә_____гҖӮ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
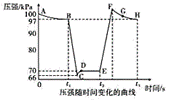
ж°®зҡ„ж°§еҢ–зү©жҳҜйҖ жҲҗеӨ§ж°”жұЎжҹ“зҡ„дё»иҰҒзү©иҙЁгҖӮз ”з©¶ж°®ж°§еҢ–зү©зҡ„еҸҚеә”жңәзҗҶеҜ№дәҺж¶ҲйҷӨзҺҜеўғжұЎжҹ“жңүйҮҚиҰҒж„Ҹд№үгҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүNO2е’ҢN2O4д»Ҙзү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә1пјҡ1дёҺO2е’ҢH2OжҒ°еҘҪе®Ңе…ЁеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә_____гҖӮ пјҲ2пјүе·ІзҹҘпјҡ2N2O5(g) N2O5(g) еҲҷеҸҚеә”2NO2(g) пјҲ3пјүеҲ©з”ЁзҺ°д»ЈжүӢжҢҒжҠҖжңҜдј ж„ҹеҷЁеҸҜд»ҘжҺўз©¶еҺӢејәеҜ№2NO2(g)
в‘ BзӮ№ж—¶NO2зҡ„иҪ¬еҢ–зҺҮдёә___пјӣBзӮ№еҸҚеә”N2O4 в‘ЎBгҖҒEдёӨзӮ№еҜ№еә”зҡ„жӯЈеҸҚеә”йҖҹзҺҮеӨ§е°ҸдёәОҪB___ОҪE(иҜ·еЎ«вҖңпјһвҖқвҖңпјңвҖқжҲ–вҖң=вҖқ)гҖӮ в‘ўEгҖҒFгҖҒGгҖҒHеӣӣзӮ№ж—¶еҜ№еә”ж°”дҪ“зҡ„е№іеқҮзӣёеҜ№еҲҶеӯҗиҙЁйҮҸжңҖеӨ§зҡ„зӮ№дёә___гҖӮ пјҲ4пјүеҸҚеә”зү©NO2еҸҜз”ұ2NO(g)пјӢO2(g) 第дёҖжӯҘNOпјӢNO 第дәҢжӯҘN2O2пјӢO2вҶ’2NO2В В В В В В В ж…ўеҸҚеә”В В В дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ_____(еЎ«ж ҮеҸ·)гҖӮ AпјҺиӢҘ第дёҖжӯҘж”ҫзғӯпјҢжё©еәҰеҚҮй«ҳпјҢжҖ»еҸҚеә”йҖҹзҺҮеҸҜиғҪеҮҸе°Ҹ BпјҺN2O2дёәиҜҘеҸҚеә”зҡ„еӮ¬еҢ–еүӮ CпјҺ第дәҢжӯҘеҸҚеә”зҡ„жҙ»еҢ–иғҪжҜ”第дёҖжӯҘеҸҚеә”зҡ„жҙ»еҢ–иғҪеӨ§ DпјҺ第дәҢжӯҘдёӯN2O2дёҺO2зҡ„зў°ж’һ100%жңүж•Ҳ
|
|
- й«ҳдәҢдёӢеҚҠжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰзҪ‘дёҠжЈҖжөӢж— зәёиҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲ2019-2020е№ҙзҰҸе»әзңҒиҺҶз”°еёӮд»ҷжёёеҺҝ第дәҢдёӯеӯҰпјү
- дә‘еҚ—й«ҳдёҖеҢ–еӯҰжңҹдёӯиҖғиҜ•пјҲ2019е№ҙдёҠеҶҢпјүе…Қиҙ№иҜ•еҚ·
- е®үеҫҪзңҒеҗҲиӮҘеёӮ第дёҖдёӯеӯҰ2020е№ҙй«ҳдёӯжҜ•дёҡзҸӯж•ҷеӯҰиҙЁйҮҸзӣ‘жөӢеҚ·зҗҶ科综еҗҲеҢ–еӯҰиҖғиҜ•
- йҒөд№үеёӮ2019е№ҙй«ҳдәҢдёҠеҶҢеҢ–еӯҰжңҲиҖғжөӢйӘҢе®Ңж•ҙиҜ•еҚ·
- жұҹиҘҝзңҒж–°дҪҷеёӮ第еӣӣдёӯеӯҰ2020еұҠй«ҳдёүдёғжңҲжЈҖжөӢеҢ–еӯҰиҖғйўҳеҗҢжӯҘи®ӯз»ғ
- иҙөе·һзңҒжҜ•иҠӮеёӮеӨ§ж–№еҺҝ第дёҖдёӯеӯҰ2020-2021е№ҙй«ҳдёҖдёҠеҶҢ第дәҢж¬ЎжңҲиҖғеҢ–еӯҰе…Қиҙ№иҜ•йўҳеёҰзӯ”жЎҲе’Ңи§Јжһҗ
- 2017е№ҙиҮі2018е№ҙй«ҳдёҖ1жңҲжңҲиҖғеҢ–еӯҰиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§ЈжһҗпјҲжІіеҢ—зңҒй«ҳйҳідёӯеӯҰпјү
- й«ҳдёҖеҢ–еӯҰдёӢеҶҢиҜҫж—¶з»ғд№ е…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ