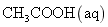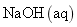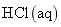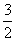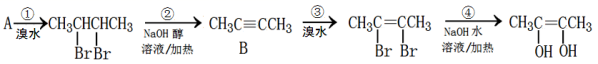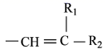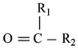宁夏市高级中学2021-2022学年高二上学期第一次月考综合联考化学试题含详解
| 1. | 详细信息 |
|
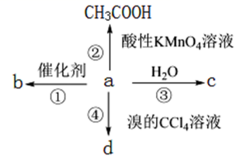
下列不属于有机化学范畴的是 A . 周朝设立 “ 酰人 ” 官职负责酿造酒、醋等 B . 侯德榜用食盐生产纯碱 C . 瑞典化学家舍勒提取到酒石酸、柠檬酸等物质 D . 维勒首次在实验室里合成了尿素 |
|
| 2. | 详细信息 |
|
下列是除去括号内杂质的有关操作,其中正确的是 A . 苯 ( 己烷 )—— 分液 B . 乙酸乙酯 ( 乙酸 )—— 加入饱和 NaOH 溶液,分液 C . CO 2 (HCl)—— 通入饱和 NaCl 溶液,洗气 D . 乙醇 ( 水 )—— 加 CaO ,蒸馏 |
|
| 3. | 详细信息 |
|
一种药物合成中间体结构简式如图。关于该化合物,下列说法正确的是 A . 属于芳香烃 B . 分子中所有碳原子不可能共平面 C . 苯环上的一氯代物有 4 种 ( 不考虑立体异构 ) D . 分子中含有两种官能团 |
|
| 4. | 详细信息 |
|
下列有关化学用语表示正确的是 A . 乙烯的结构简式: C 2 H 4 B . 丙烷分子的球棍模型: C . 空间填充模型 D . CH 2 Cl 2 的电子式为 |
|
| 5. | 详细信息 |
|
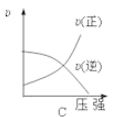
下列关系正确的是 A . 沸点:正戊烷> 2 , 2 -二甲基戊烷> 2 , 3 -二甲基丁烷>丙烷 B . 密度: CCl 4 >苯> H 2 O C . 同物质的量物质燃烧耗 O 2 量:环已烷>苯>甲苯 D . 同质量的物质燃烧耗 O 2 量:甲烷>乙烷>乙烯>乙炔 |
|
| 6. | 详细信息 | ||||||||||||||||||||||
|
分析表中各项的排布规律,按此规律排布第 26 项应为
A . C 7 H 16 B . C 7 H 14 O 2 C . C 8 H 18 D . C 8 H 18 O |
|||||||||||||||||||||||
| 7. | 详细信息 |
|
某单烯烃与氢气加成后得到的饱和烃如图所示,该烯烃可能的结构有 ( 考虑立体异构 ) A . 2 种 B . 3 种 C . 4 种 D . 5 种 |
|
| 8. | 详细信息 |
|
下列事实、事件、事故中与甲烷无关的是 A .天然气的主要成分 B .石油经过催化裂化及裂解后的产物 C . “ 西气东输 ” 中气体 D .煤矿中的瓦斯爆炸 |
|
| 9. | 详细信息 |
|
下列说法正确的是 A . 正戊烷分子中所有原子均在一条直线上 B . 分子组成符合 C n H 2n+2 (n 为正整数 ) 的烃一定是烷烃 C . 碳、氢原子个数之比为 1∶3 的烃有 2 种 D . 碳碳间以单键结合,碳原子的剩余价键全部与氢原子结合的烃一定是饱和链烃 |
|
| 10. | 详细信息 |
|
下列物质属于芳香烃,但不是苯的同系物的是( ) A . |
|
| 11. | 详细信息 |
|
下列卤代烃,既能发生水解反应,又能发生消去反应且只能得到一种单烯烃的是 A . B . C . D . |
|
| 12. | 详细信息 |
|
二氟甲烷是性能优异的环保产品,它可替代某些会破坏臭氧层的 “ 氟利昂 ” 产品,用作空调、冰箱和冷冻库的致冷剂。试判断二氟甲烷的结构有( ) A . 4 种 B . 3 种 C . 2 种 D . 1 种 |
|
| 13. | 详细信息 |
|
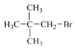
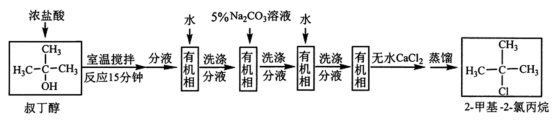
2 —甲基— 2 —氯丙烷是重要的化工原料,实验室中可由叔丁醇与浓盐酸反应制备,路线如图: 已知:叔丁醇:沸点 83 ℃, 2 —甲基— 2 —氯丙烷:沸点 50.7 ℃,密度 0.874g/cm 3 。 下列说法正确的是 A . 叔丁醇中的官能团的电子式为 B . 用 5%Na 2 CO 3 溶液洗涤分液时,有机相在分液漏斗的下层 C . 无水 CaCl 2 的作用是除去有机相中残存的少量水,也可用 NaOH 固体代替无水 CaCl 2 D . 蒸馏除去残余反应物叔丁醇时,产物先蒸馏出体系 |
|
| 14. | 详细信息 |
|
下列说法中 错误 的是 A . 聚乙烯能与溴的四氯化碳溶液发生加成反应 B . C 2 H 4 与 C 4 H 8 可能不属于同系物 C . 甲苯能使酸性高锰酸钾溶液褪色,说明苯环对侧链的性质产生了影响 D . 石油催化重整可获得芳香烃 |
|
| 15. | 详细信息 |
|
下列装置或简易装置,可以用于实验室制乙炔的是 A . |
|
| 16. | 详细信息 |
|
在核磁共振氢谱中出现两组峰,其氢原子数之比为 1 : 1 的化合物是 A . CH 3 CH 2 CH 3 B . C . CH 3 — O — CH 3 D . |
|
| 17. | 详细信息 |
|
下面反应: ①由乙炔制氯乙烯 ②乙烷在空气中燃烧③乙烯使溴的四氯化碳溶液褪色 ④乙烯使酸性高锰酸钾溶液褪色 ⑤由乙烯制聚乙烯 ⑥乙烷与氯气在光照的条件下反应 ⑦溴乙烷和氢氧化钠乙醇溶液共热;⑧溴乙烷和氢氧化钠溶液共热; 其中属于取代反应的是( ) A . ⑥⑧ B . ②④ C . ①③ D . ⑦⑧ |
|
| 18. | 详细信息 |
|
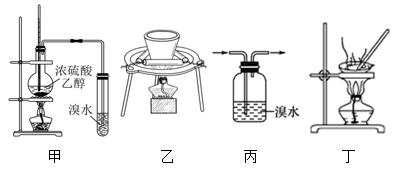
下列实验操作正确且能达到对应实验目的的是 A . 装置甲制备并检验乙烯 B . 装置乙煤的干馏 C . 装置丙除去乙烷中的乙烯 D . 装置丁提纯乙酸乙酯 |
|
| 19. | 详细信息 |
|
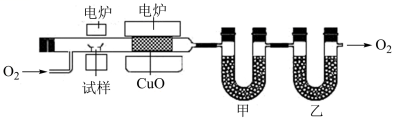
某同学尝试利用李比希法测定液态烃 X 的实验式,设计了如下实验:准确称取 1 . 06g 样品并置于试样盒中,加热样品,使蒸气通过氧化铜 (催化剂),准确称量生成的二氧化碳和水的质量,分别是 3 . 52g 和 0 . 9g 。下列说法正确的是 A . 甲处放置碱石灰 B . 该烃的实验式是 C . 停止加热后,立即停止通入 D . 乙装置后加装一个盛碱石灰的干燥管,实验结果会更准确 |
|
| 20. | 详细信息 |
|
可以用分液漏斗进行分离的混合物是 A . 正己烷和水 B . 酒精和碘水 C . 乙酸和乙酸乙酯 D . 乙酸和乙醇 |
|
| 21. | 详细信息 |
|
下列关于物质的制备、鉴别与除杂的说法正确的是( ) A . 乙烷中混有少量乙烯:通入氢气在一定条件下反应,使乙烯转化为乙烷 B . 氯气与甲烷按照比例 2 : 1 在光照条件下反应制备纯净的二氯甲烷 C . 只用溴水就能将苯、己烯、四氯化碳溶液区分开来 D . 在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后要冷却到常温再过滤 |
|
| 22. | 详细信息 |
|
丙烷 (C 3 H 8 ) 通常用来作为发动机及家用取暖系统的燃料。下列有关丙烷的说法正确的是 A . 丙烷属于有机化合物,完全燃烧生成二氧化碳和水 B . 丙烷中含有 H 2 分子 C . 丙烷中碳、氢元素质量比为 3 : 8 D . 丙烷由 3 个碳原子和 8 个氢原子构成 |
|
| 23. | 详细信息 |
|
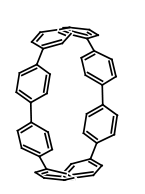
最近科学家合成了如下图由八个苯环组成的环状分子,下列有 关说法中,不正确的是 A . 该化合物中碳的含量比苯高 B . 该化合物属于苯的同系物,不溶于水 C . 该化合物具有能够容纳小分子的空腔 D . 该化合物可发生取代反应 |
|
| 24. | 详细信息 |
|
下列关于有机物的说法正确的是 A . 乙醇和丙三醇互为同系物 B . 环己烯 ( C . 分子式为 C 5 H 10 O 2 且属于酯的同分异构体共有 9 种 ( 不考虑立体异构 ) D . |
|
| 25. | 详细信息 |
|
下列说法不正确的是( ) A . 放热反应不需加热即可发生 B . 化学反应过程中的能量变化除了热能外,也可以是光能、电能等 C . 需要加热才能进行的化学反应不一定是吸热反应 D . 化学反应热效应数值与参加反应的物质多少有关 |
|
| 26. | 详细信息 |
|
下列说法正确的是( ) A . 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 B . 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 C . 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 D . 催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
|
| 27. | 详细信息 |
|
对于可逆反应: 2SO 2 (g)+O 2 (g) A . 增大压强 B . 升高温度 C . 使用催化剂 D . 多充入 O 2 |
|
| 28. | 详细信息 |
|
在 2A+B=3C+4D 反应中,表示该反应速率最快的是 A . v (A)=0.5mol·L -1 ·s -1 B . v (B)=0.3mol·L -1 ·s -1 C . v (C)=0.8mol·L -1 ·s -1 D . v (D)=1mol·L -1 ·s -1 |
|
| 29. | 详细信息 |
|
在一定温度下可逆反应 H 2 (g)+I 2 (g) A . 有 1mol H-H 键断裂,同时有 1 mol I-I 键形成 B . 容器内压强不再随时间而变化 C . 单位时间内反应掉 n mol I 2 同时生成 2n mol HI D . H 2 、 I 2 、 HI 的浓度之比为 1 ∶ 1 ∶ 2 |
|
| 30. | 详细信息 |
|
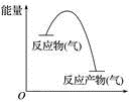
从如图所示的某气体反应的能量变化分析,以下判断错误的是( ) A . 这是一个放热反应 B . 该反应可能需要加热 C . 反应产物的总能量低于反应物的总能量 D . 反应物比反应产物更稳定 |
|
| 31. | 详细信息 |
|
对于放热反应 H 2 +Cl 2 A .该反应涉及到离子键和共价键的断裂与形成 B .该反应中,化学能只转变为热能 C .断开 1molH ﹣ H 键和 1molCl ﹣ Cl 键所吸收的总能量,小于形成 1molH ﹣ Cl 键所放出的能量 D .反应物所具有的总能量高于产物所具有的总能量 |
|
| 32. | 详细信息 |
|
已知中和热的数值是 A . 500mL1 B . 500mL C . D . |
|
| 33. | 详细信息 |
|
某温度下,密闭容器中发生反应 aX ( g ) A . 可逆反应的化学方程式的化学计量数: a > b + c B . 压缩容器的容积时, v 正 增大, v 逆 减小 C . 达到新平衡时,物质 X 的转化率减小 D . 达到新平衡时,混合物中 Z 的质量分数增大 |
|
| 34. | 详细信息 |
|
肼 (N 2 H 4 ) 是火箭发动机的燃料,它与 N 2 O 4 反应生成氮气和水蒸气。已知: ① N 2 (g) + 2O 2 (g)===N 2 O 4 (g)Δ H =+ 8.7 kJ·mol - 1 ② N 2 H 4 (g) + O 2 (g)===N 2 (g) + 2H 2 O(g)Δ H =- 534.0 kJ·mol - 1 下列表示肼跟 N 2 O 4 反应的热化学方程式正确的是 A . 2N 2 H 4 (g) + N 2 O 4 (g)===3N 2 (g) + 4H 2 O(g) Δ H =- 542.7 kJ·mol - 1 B . 2N 2 H 4 (g) + N 2 O 4 (g)===3N 2 (g) + 4H 2 O(g) Δ H =- 1 076.7 kJ·mol - 1 C . N 2 H 4 (g) + D . 2N 2 H 4 (g) + N 2 O 4 (g)===3N 2 (g) + 4H 2 O(g) Δ H =- 1 059.3 kJ·mol - 1 |
|
| 35. | 详细信息 | ||||||||||||
|
常温下, 1mol 化学键分解成气态原子所需要的能量用 E 表示.结合表中信息判断下列说法不正确的是
A . 432kJ/mol>E(H-Br)>298kJ/mol B . 表中最稳定的共价键是 H-F 键 C . H 2 (g)→2H(g)∆ H =+436kJ/mol D . H 2 (g)+F 2 (g)=2HF(g) ∆ H =-25kJ/mol |
|||||||||||||
| 36. | 详细信息 |
|
下列说法正确的是( ) A . 同温同压下, H 2 (g) + Cl 2 (g)===2HCl(g) 在光照和点燃条件下的 ΔH 不同 B . 已知 4P (红磷, s ) ===P 4 (白磷, s ) △ H=+17 kJ/mol ,则白磷比红磷更稳定 C . 已知 2H 2 (g)+O 2 (g) ===2H 2 O(l) △ H= - 571.6kJ/mol ,则氢气的燃烧热为 285.8 kJ/mol D . 稀溶液中: H + ( aq ) +OH - ( aq ) ===H 2 O(l) ΔH= - 53.7 kJ/mol ,将含 1 mol CH 3 COOH 与含 1 molNaOH 的稀溶液混合,放出的热量等于 53.7 kJ |
|
| 37. | 详细信息 |
|
可逆反应 2A(g)+3B(g) A . 反应速率 v(C)= 1mol/(L·s) B . C 的平衡浓度为 4mol /L C . A 的转化率为 25% D . B 的平衡浓度为 1.5mol /L |
|
| 38. | 详细信息 |
|
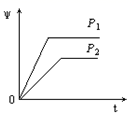
对于可逆反应 2SO 2 (g) + O 2 (g) ⇌ 2SO 3 (g) △ H<0 ,在一定温度下其平衡常数为 K ,下列说法正确的是 A . 增大 SO 2 的转化率 K 值一定增大 B . 减小压强 K 值减小 C . 升高温度 K 值增大 D . K 值越大 SO 2 转化率越高 |
|
| 39. | 详细信息 |
|
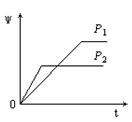
对于可逆反应: 2M(g)+N(g) A . C . |
|
| 40. | 详细信息 |
|
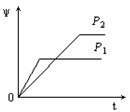
在一定温度不同压强 ( P 1 < P 2 )下,可逆反应 2X ( g ) A . C . |
|
| 41. | 详细信息 |
|
在一个容积为 2 L 的密闭容器中,加入 0.8 mol 的 A 2 气体和 0.6 mol B 2 气体,一定条件下发生如下反应: A 2 (g)+B 2 (g) A . 图中 a 点的值为 0.15 B . 该反应的平衡常数 K=0.03 C . 温度升高,平衡常数 K 值减小 D . 平衡时 A 2 的转化率为 62.5% |
|
| 42. | 详细信息 |
|
将等物质的量的 X 、 Y 气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡: X(g) + Y(g) ⇌ 2Z(g) Δ H < 0 。当改变某个条件并达到新平衡后,下列叙述正确的是 ( ) A . 升高温度, X 的体积分数减小 B . 增大压强 ( 缩小容器体积 ) , Z 的浓度不变 C . 保持容器体积不变,充入一定量的惰性气体, Y 的浓度不变 D . 保持容器体积不变,充入一定量的 Z , X 的体积分数增大 |
|
| 43. | 详细信息 |
|
下列有关叙述正确的是 ( ) A . 如图所示,测定中和热时,大小两烧杯间填满碎纸条或泡沫塑料的目的是固定小烧杯 B . 若用 50 mL 0.55 mol·L - 1 的氢氧化钠溶液,分别与 50 mL 0.50 mol·L - 1 的盐酸和 50 mL 0.50 mol·L - 1 的硫酸充分反应,两反应测定的中和热不相等 C . 为了简化装置,中和热测定实验中的环形玻璃搅拌棒可以由温度计代替 D . 中和热测定实验也可以用稀硫酸与氢氧化钠溶液反应 |
|
| 44. | 详细信息 |
|
现在和将来的社会,对能源和材料的需求是越来越大,我们学习化学就为了认识物质,创造物质,开发新能源,发展人类的新未来。请解决以下有关能源的问题: ( 1 ) 未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是: _______ ①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能 A . ①②③④ B . ⑤⑥⑦⑧ C . ③⑤⑥⑦⑧ D . ③④⑤⑥⑦⑧ ( 2 ) 运动会上使用的火炬的燃料一般是丙烷 (C 3 H 8 ) ,请根据完成下列题目。 ①已知 11g 丙烷 (C 3 H 8 ) 在 298K 和 101Kpa 条件下完全燃烧生成 CO 2 和液态水时放出的热量 为 555kJ ,请写出丙烷燃烧热的热化学方程式: _______ ; ②丙烷在一定条件下发生脱氢反应可以得到丙烯。 已知: C 3 H 8 (g)→CH 4 (g) + HC≡CH(g) + H 2 (g) △ H 1 =+156.6kJ·mol -1 CH 3 CH=CH 2 (g)→CH 4 (g) + HC≡CH(g) △ H 2 =+32.4kJ·mol -1 则相同条件下,反应 C 3 H 8 (g)→CH 3 CH=CH 2 (g) + H 2 (g) 的 △ H= _______ ( 3 ) 已知: H—H 键的键能为 436kJ/mol , H—N 键的键能为 391kJ/mol ,根据化学方程式: N 2 +3H 2 ⇌ 2NH 3 ΔH=-92.4kJ/mol 。 ①请计算出 N≡N 键的键能为 _______ 。 ②若向处于上述热化学方程式相同温度和体积一定的容器中,通入 1molN 2 和 3molH 2 ,充 分反应后,恢复原温度时放出的热量 _______ 92.4KJ( 填大于或小于或等于 ) ,理由: _______ 。 |
|
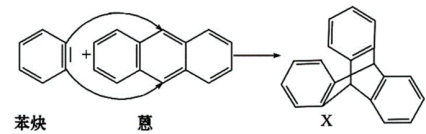
| 45. | 详细信息 |
|
蒽 ( ( 1 ) 蒽与 X 都属于 ___ 。 A. 环烃 B. 烷烃 C. 不饱和烃 ( 2 ) 苯炔的分子式为 ___ ,苯炔不具有的性质是 ___ 。 A. 能溶于水 B. 能发生氧化反应 C. 能发生加成反应 D. 常温常压下为气体 ( 3 ) X 的一氯代物有 ___ 种 ( 不考虑立体异构 ) 。 ( 4 ) 苯是最简单的芳香烃,能证明其化学键不是单双键交替排列的事实是 ___ 。 A . 它的对位二元取代物只有一种 B . 它的邻位二元取代物只有一种 C . 分子中所有碳碳键的键长均相等 D . 能发生取代反应和加成反应 ( 5 ) |
|
| 46. | 详细信息 |
|
已知 A 是一种烃类,其相对分子质量为 56 , 1molA 与氧气充分燃烧后生成 4molCO 2 ,从化合物 A 出发有以下转化关系: 根据以上信息,回答以下问题: ( 1 ) 化合物 A 的结构简式为 ___ 。 ( 2 ) 反应 ②的化学方程式为 ___ 。 ( 3 ) 反应 ④属于反应 ___ ( 反应类型 ) 。 ( 4 ) 化合物 B 一定条件下可以与氢气发生加成反应, 1molB 最多可以消耗 ___ molH 2 ,请写出该反应的化学方程式: ___ 。 |
|
| 47. | 详细信息 |
|
有机物 a 的分子式为 C 5 H 10 ,核磁共振氢谱上显示有 3 种不同化学环境的氢且峰面积之比为 6 : 3 : 1 , a 在一定条件下能发生如图所示的反应,其中 b 为高分子化合物。 已知: 回答下列问题: ( 1 ) a 的系统命名为 ___ , a→b 的反应类型为 ___ 。 ( 2 ) 不对称烯烃加成时氢原子首先加到碳碳双键上含氢较多的碳上, c 的结构简式为 ___ 。 ( 3 ) d 与氢氧化钠的水溶液在加热条件下发生反应的化学方程式为 ___ 。 ( 4 ) 下列关于 b 的说法正确的是 ___ ( 填标号 ) 。 A. 为混合物 B. 能使酸性高锰酸钾溶液褪色 C.0.1molb 完全燃烧可消耗 7.5molO 2 |
|
| 48. | 详细信息 |
|
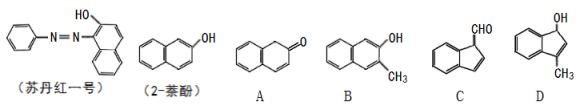
回答下列问题: ( 1 ) 写出 2,3− 二甲基戊烷的结构简式 ___ 。 ( 2 ) 试写出三氯甲烷在光照条件下与氯气反应的化学方程式: ___ 。 ( 3 ) 苏丹红一号是一种偶氮染料,不能作为食品添加剂使用。它是以苯胺和 2− 萘酚为主要原料制备得到的,苏丹红一号和 2− 萘酚的结构简式如图所示: ① 苏丹红一号的分子式为 ___ 。 ② 化合物 A~D 中,与 2− 萘酚互为同系物的是 ( 填序号 ) ___ ;有机物 C 含有的官能团名称是 ___ 。 |
|
| 49. | 详细信息 |
|
依据事实写出下列反应的热化学方程式: ( 1 ) 1molC 2 H 5 OH(l) 完全燃烧生成 CO 2 (g) 和 H 2 O(l) ,放出 1366.8kJ 热量 _______ ( 2 ) 1molC( 石墨, s) 与适量 H 2 O(g) 完全反应生成 CO(g) 和 H 2 (g) ,吸收 131.3KJ 热量; _______ ( 3 ) 25℃ , 101KPa 条件下, 1g 甲醇燃烧生成 CO 2 (g) 和 H 2 O(l) 放热 22.68KJ ,则甲醇的燃烧热的热方程式为 _______ |
|
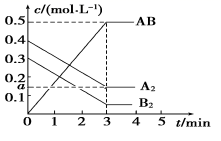
| 50. | 详细信息 |
|
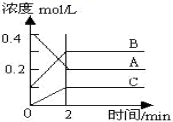
如图所示为 800℃ 时 A 、 B 、 C 三种气体在密闭容器中反应时浓度的变化情况,根据图回答下列问题。 ( 1 ) 写出该反应的方程式: _______ ( 2 ) 前 2 min A 的分解速率为 _______ ( 3 ) 达到平衡后,若增大压强,平衡向 _______ 方向移动 ( 4 ) 该反应的平衡常数 K = _______ |
|
| 51. | 详细信息 |
|
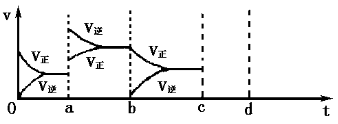
回答下列问题: ( 1 ) 对于下列反应: 2SO 2 + O 2 ①若 2min 内 SO 2 的浓度由 6 mol/L 下降为 2 mol/L ,那么,用 SO 2 表示的化学反应速率 _______ 。 ②如果开始时 SO 2 浓度为 4mol/L , 2min 后反应达平衡,若这段时间内 v (O 2 ) 为 0.5mol/(L· min) ,那么 2min 时 SO 2 的浓度为 _______ 。 ( 2 ) 下图表示在密闭容器中反应: 2SO 2 +O 2 |
|
| 52. | 详细信息 |
|
在容积为 2L 的密闭容器中充入 3mol 气体 A 和 2.5mol 气体 B, 发生反应: 3A(g)+B(g) ( 1 )方程式中 C 的化学计量数 x= ________ 。 ( 2)5min 内 A 的平均反应速率 v(A)= ________ 。 ( 3)5min 时 B 的转化率为 ________ 。 ( 4 )温度升高 A 的转化率 ________ (填 “ 增大 ”、“ 减小 ” 或 “ 不变 ” );压强增大 B 的转化率 ________ 。 |
|
| 53. | 详细信息 | ||||||||||||||||||||
|
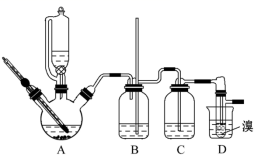
实验室制备 1 , 2 —二溴乙烷的反应原理如下: CH 3 CH 2 OH 可能存在的主要副反应有:乙醇在浓硫酸的存在下在 140 ℃脱水生成乙醚。 用少量溴和足量的乙醇制备 1 , 2 —二溴乙烷的装置如图所示:
回答下列问题: ( 1 ) 在此制备实验中,要尽可能迅速地把反应温度提高到 170 ℃左右,其最主要目的是 ___ ( 填正确选项前的字母 ) 。 a. 引发反应 b. 加快反应速度 c. 防止乙醇挥发 d. 减少副产物乙醚生成 ( 2 ) 在装置 C 中应加入 ___ ,其目的是吸收反应中可能生成的酸性气体 ( 填字母 ) 。 a. 水 b. 氢氧化钠溶液 c. 浓硫酸 ( 3 ) 判断该制备反应已经结束的最简单方法是 ___ 。 ( 4 ) 若产物中有少量未反应的 Br 2 ,最好用 ___ 洗涤除去 ( 填正确选项前的字母 ) 。 a. 水 b. 乙醇 c. 氢氧化钠溶液 ( 5 ) 若产物中有少量副产物乙醚,可用的 ___ 方法除去。 ( 6 ) 反应过程中应用冷水冷却装置 D ,其主要目的是 ___ ;但又不能过度冷却 ( 如用冰水 ) ,其原因是 ___ 。 |
|||||||||||||||||||||