第二章 化学物质及其变化 知识点题库
分类是学习和研究化学的一种重要方法,下列分类合理的是( )
A . 烧碱和纯碱都属于碱
B . 硫酸和盐酸都属于含氧酸
C . Na2SiO3和Na2SO4都属于钠盐
D . Fe2O3和Al2O3都属于碱性氧化物
下列离子方程式中书写正确的是( )
A . 氧化亚铁与稀盐酸反应:FeO+2H+=Fe3++H2O
B . Na与CuSO4溶液反应:2Na+Cu2+═2Na++Cu
C . 钠与水反应:Na+H2O=Na++OH-+H2↑
D . 将氢氧化铁胶体放入过量的盐酸:Fe(OH)3+3H+=Fe3++3H2O
下列反应中,水作氧化剂的是( )
A . CaO+H2O→Ca(OH)2
B . 2K+2H2O→2KOH+H2↑
C . 3NO2+H2O → 2HNO3+NO
D . 2H2O2→2H2O+O2↑
常温下,已知Ka1(H2CO3)=4.3×10-7 , Ka2(H2CO3)=5.6×10-11。某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述正确的是( )
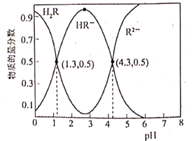
A . H2R的二级电离常数Ka2的数量级为10-5
B . 在pH=4的溶液中:3c(R2-)<c(Na+)+c(H+)-c(OH-)
C . 等体积、等浓度的NaOH浴液与H2R溶液混合后,溶液中:(R2-)<c(H2R)
D . 向Na2CO3溶液中加入过量H2R溶液,发生的反应是: CO3- +H2R=CO2↑+H2O+R2-
CO2的转化一直是世界范围内的研究热点。利用两种金属催化剂,在水溶液体系中将CO2分别转化为CO和HCOOH的反应过程示意图如下:
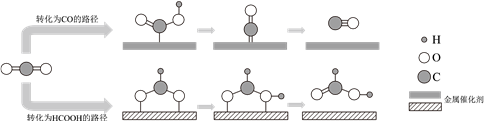
下列说法正确的是( )
A . 在转化为CO的路径中,只涉及碳氧键的断裂和氧氢键的形成
B . 在转化为HCOOH的路径中,CO2被氧化为HCOOH
C . 在转化为两种产物的过程中碳、氧原子的利用率均为100%
D . 上述反应过程说明催化剂具有选择性
某化工厂利用软锰矿(主要成分为MnO2 , 另含有少量Fe2O3、CaO、CuO、SiO2等杂质)脱除燃煤尾气中的SO2 , 同时制得电池材料MnO2.工艺流程如下:
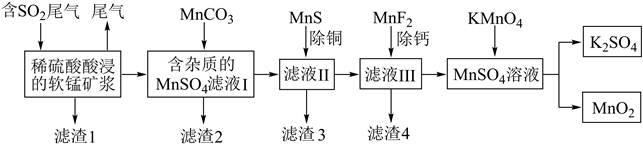
-
(1) 滤渣1的成分是(填化学式),提高软锰矿酸浸速率的措施有(任答一条)。
-
(2) 写出脱硫过程中二氧化锰转化为硫酸锰的化学反应方程式。
-
(3) 加入碳酸锰的作用。
-
(4) 写出高锰酸钾与硫酸锰发生反应的离子方程式。
-
(5) 实验室检验钾离子的操作方法是
-
(6) 已知25℃时Ksp[Fe(OH)3]=4.0×10-38 , 欲使铁离子沉淀完全,应调节溶液pH不低于。(设
 =a,结果用含a的代数式表示)。
=a,结果用含a的代数式表示)。
反应 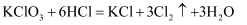 中,下列说法正确的是( )
中,下列说法正确的是( )
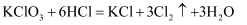 中,下列说法正确的是( )
中,下列说法正确的是( )
A . 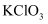 中的
中的 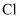 元素被氧化
B .
元素被氧化
B .  是还原产物
C . 氧化剂与还原剂的物质的量之比1:6
D . 氧化产物与还原产物的物质的量之比5:1
是还原产物
C . 氧化剂与还原剂的物质的量之比1:6
D . 氧化产物与还原产物的物质的量之比5:1
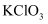 中的
中的 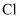 元素被氧化
B .
元素被氧化
B .  是还原产物
C . 氧化剂与还原剂的物质的量之比1:6
D . 氧化产物与还原产物的物质的量之比5:1
是还原产物
C . 氧化剂与还原剂的物质的量之比1:6
D . 氧化产物与还原产物的物质的量之比5:1
氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C  2AlN+3CO合成。下列关于该反应的叙述正确的是( )
2AlN+3CO合成。下列关于该反应的叙述正确的是( )
 2AlN+3CO合成。下列关于该反应的叙述正确的是( )
2AlN+3CO合成。下列关于该反应的叙述正确的是( )
A . 氧化剂与还原剂的物质的量之比为3:1
B . AlN是还原反应的产物
C . 反应中Al2O3被还原
D . 每生成1 mol AlN,转移电子的物质的量为6 mol
某化学兴趣小组进行如图所示实验,以检验化学反应中的能量变化。
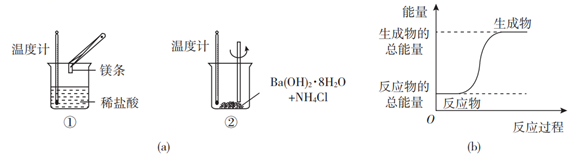
请回答下列问题:
-
(1) 反应①的离子方程式是;反应②的化学方程式是。
-
(2) 反应(填“①”或“②”)的能量变化可用图(b)表示。
-
(3) 现有如下两个反应:
A.NaOH+HCl=NaCl+H2O B.2FeCl3+Cu=2FeCl2+CuCl2
①A反应不能设计成原电池的原因是。
②利用B反应可设计成原电池,该电池正极的电极反应式为,可用做该电池正极材料的是(填序号)。
a.碳棒 b.铁片 c.铜片 d.铂棒
在NO2被水吸收的反应中,发生还原反应和发生氧化反应物质质量比为( )
A . 3∶1
B . 1∶3
C . 1∶2
D . 2∶1
-
(1) 火药是中国的“四大发明"之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S=K2S+2NO2↑+3CO2↑。其中被还原的元素的名称是,氧化产物是。
-
(2) 在KClO3+6HCl=KCl+3Cl2↑+3H2O的反应中,被氧化的氯原子与被还原的氯原子的物质的量比是。
-
(3) 强酸性的未知无色溶液中可能含有大量的Cl-、S2-、NO
 、CO
、CO  、NH
、NH  、Cu2+、Fe3+、Ag+等,现已检出有Ag+ , 你认为其中离子还需要鉴定是否存在,请写出检验该离子的离子方程式。
、Cu2+、Fe3+、Ag+等,现已检出有Ag+ , 你认为其中离子还需要鉴定是否存在,请写出检验该离子的离子方程式。
将H2S和空气的混合气体通入制造印刷电路板的废液中(含FeCl3、FeCl2、CuCl2),可变废为宝回收S,转化关系如图所示。下列说法错误的是( )
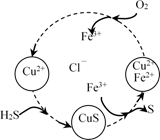
A . 该过程的总反应为:2H2S+O2=2S+2H2O
B . 由图示转化可知氧化性:O2>Fe3+>S
C . 在转化过程中,废液里的FeCl3、FeCl2、CuCl2可循环利用
D . 转化过程中涉及到的反应均为氧化还原反应
以CCl4和金属钠为材料,在700℃时制造出纳米级的金刚石粉末和氯化钠,被科学家们高度评价为“稻草变黄金”。下列说法错误的是( )
A . 金刚石属于金属单质
B . 制造过程中元素种类没有改变
C . CCl4是一种化合物
D . 这个反应是置换反应
下列说法错误的是( )
A . 某些胶态金属氧化物分散于玻璃中可制成有色玻璃
B . 以NaCl为原料,工业上可制备纯碱和烧碱
C . 牺牲阳极的阴极保护法是利用原电池原理保护金属的一种方法
D . 通常,只有那些分子较小、分子形状呈长形或碟形的物质,才易形成液晶态
下列表示对应化学反应的离子方程式正确的是( )
A . 向稀硫酸中加入铁粉: 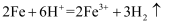 B . NO2与水的反应:
B . NO2与水的反应:  C . 冷的氢氧化钠溶液中通入氯气:
C . 冷的氢氧化钠溶液中通入氯气: 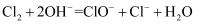 D . 醋酸溶液与水垢中的CaCO3反应:
D . 醋酸溶液与水垢中的CaCO3反应: 
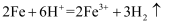 B . NO2与水的反应:
B . NO2与水的反应:  C . 冷的氢氧化钠溶液中通入氯气:
C . 冷的氢氧化钠溶液中通入氯气: 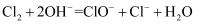 D . 醋酸溶液与水垢中的CaCO3反应:
D . 醋酸溶液与水垢中的CaCO3反应: 
反应3Fe+ 4H2O(g)  Fe3O4+4H2中, 还原剂是( )
Fe3O4+4H2中, 还原剂是( )
 Fe3O4+4H2中, 还原剂是( )
Fe3O4+4H2中, 还原剂是( )
A . Fe
B . H2O
C . Fe3O4
D . H2
下列各反应的离子方程式书写正确的是( )
A . 用铜作电极电解AgNO3溶液:4Ag++2H2O  4Ag+O2↑+4H+
B . 向苯酚溶液中滴加Na2CO3溶液:C6H5OH+CO
4Ag+O2↑+4H+
B . 向苯酚溶液中滴加Na2CO3溶液:C6H5OH+CO 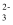 →C6H5O-+HCO
→C6H5O-+HCO  C . 向AgCl悬浊液中通入H2S气体:2AgCl(s)+S2-(aq)⇌Ag2S(s)+2Cl-(aq)
D . 碱性锌锰电池放电时正极的电极反应:MnO2+e-+H+=MnO(OH)
C . 向AgCl悬浊液中通入H2S气体:2AgCl(s)+S2-(aq)⇌Ag2S(s)+2Cl-(aq)
D . 碱性锌锰电池放电时正极的电极反应:MnO2+e-+H+=MnO(OH)
 4Ag+O2↑+4H+
B . 向苯酚溶液中滴加Na2CO3溶液:C6H5OH+CO
4Ag+O2↑+4H+
B . 向苯酚溶液中滴加Na2CO3溶液:C6H5OH+CO 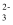 →C6H5O-+HCO
→C6H5O-+HCO  C . 向AgCl悬浊液中通入H2S气体:2AgCl(s)+S2-(aq)⇌Ag2S(s)+2Cl-(aq)
D . 碱性锌锰电池放电时正极的电极反应:MnO2+e-+H+=MnO(OH)
C . 向AgCl悬浊液中通入H2S气体:2AgCl(s)+S2-(aq)⇌Ag2S(s)+2Cl-(aq)
D . 碱性锌锰电池放电时正极的电极反应:MnO2+e-+H+=MnO(OH)
当光束通过下列物质时,不会出现丁达尔效应的是( )
A . Fe(OH)3胶体
B . CuSO4溶液
C . 有色玻璃
D . 云、雾
化合物M是一种白色粉末,由四种原子序数小于30的元素组成。为探究M的组成,某高中探究性学习小组进行如下实验:

已知:①白色固体B可溶于无色气体C的水溶液中得到无色溶液
②流程中部分生成物已略去,气体产物完全逸出,沉淀均洗涤干净。请回答:
-
(1) 组成M的非金属元素有,C分子的电子式为。
-
(2) 写出M与盐酸反应的化学方程式。
-
(3) 请写出白色固体B溶于无色气体C的水溶液中得到无色溶液的离子方程式。
-
(4) 无色气体C可用于处理硝酸工厂的尾气,把尾气中的氮氧化物(
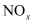 )转化为对空气无污染的物质,请写出该反应的化学方程式。
)转化为对空气无污染的物质,请写出该反应的化学方程式。
-
(5) 试设计实验检验沉淀D中的阳离子:。
常温下,在下列各组指定溶液中一定能大量共存的是( )
A . 无色溶液:K+、Na+、MnO 、SO
、SO B . 能使pH试纸变深蓝色的溶液:Cl-、HCO
B . 能使pH试纸变深蓝色的溶液:Cl-、HCO 、SO
、SO 、Na+
C . 碱性溶液:K+、SO
、Na+
C . 碱性溶液:K+、SO 、NO
、NO 、Cu2+
D . 酸性溶液:Mg2+、Na+、SO
、Cu2+
D . 酸性溶液:Mg2+、Na+、SO 、Cl-
、Cl-
 、SO
、SO B . 能使pH试纸变深蓝色的溶液:Cl-、HCO
B . 能使pH试纸变深蓝色的溶液:Cl-、HCO 、SO
、SO 、Na+
C . 碱性溶液:K+、SO
、Na+
C . 碱性溶液:K+、SO 、NO
、NO 、Cu2+
D . 酸性溶液:Mg2+、Na+、SO
、Cu2+
D . 酸性溶液:Mg2+、Na+、SO 、Cl-
、Cl-
最近更新



