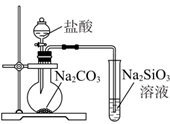
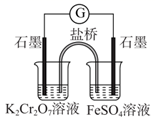
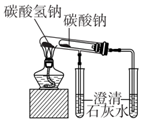
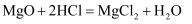第二章 化学物质及其变化 知识点题库
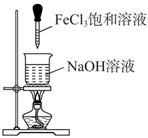
请填写下列空白:
-
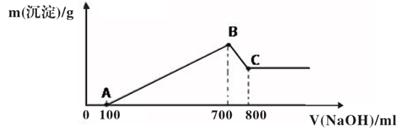
(1) 图中B点沉淀的成分(填化学式)
-
(2) 写出AB段发生反应的离子方程式, ;
-
(3) 写出BC段发生反应的离子方程式;
-
(4) 合金中铝的质量为;
-
(5) 盐酸的物质的量浓度(假设反应后溶液体积不变)是 。
| 实验 | 现象 | 结论 | |
| A | 向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐期消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
| B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
| C | 加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
| D | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
请将选择合适物质的序号填在横线上。
-
(1) 其中能导电的是; 属于非电解质的是;
属于强电解质的是;属于弱电解质的是。
-
(2) 按要求回答问题:
① 写出物质⑥的溶液与硫酸氢钠溶液反应的离子方程式:;
② 写出⑤和足量的⑦反应的离子方程式:;
③ 写出⑨的水溶液和⑩反应的化学方程式:;
-
(1) 过氧化钠与二氧化碳反应的化学方程式:。
-
(2) 氯化亚铁溶液中通入氯气的离子方程式:。
-
(3) 配平下列方程式: Cr(OH)
 +OH-+ClO-=CrO
+OH-+ClO-=CrO  + Cl-+H2O
+ Cl-+H2O
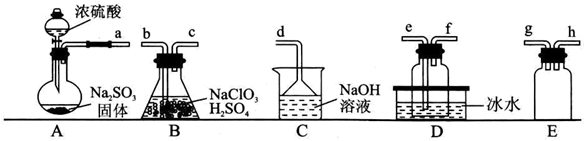
已知:浓硫酸与Na2SO3固体反应可用来制备SO2 , 二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成  。回答下列问题:
。回答下列问题:
-
(1) A中盛装Na2SO3固体的仪器名称为。
-
(2) 通过装置B中反应制备ClO2 , 氧化剂和还原剂的物质的量之比为。
-
(3) 欲制备一瓶ClO2 , 选择上图中的装置,其接口的连接顺序为a-g-h-。
-
(4) 装置D盛放冰水的目的。
-
(5) 证明ClO2的氧化性比Fe3+强的实验方案是。
-
(6) “有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力(还原产物均为氯离子)。ClO2的有效氯含量为克(计算结果保留一位小数)。
-
(1) 属于盐的物质是(填序号,下同)。
-
(2) 溶液显碱性的是。
-
(3) 分析①与②反应,i表示的内容为。
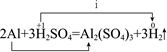
a.得到e-×6,化合价升高,被还原
b.得到e-×6,化合价降低,被还原
c.失去e-×6,化合价升高,被氧化
-
(4) ①与④发生反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,还原剂是。
-
(5) 写出③与④反应的离子方程式。
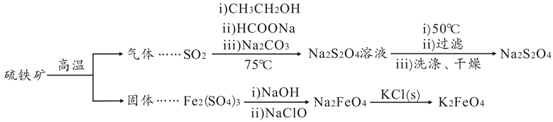
-
(1) FeS2中含有S22-离子,其电子式为。“气体”的主要成分是O2、SO2和N2 , 参考表中的数据,简述工业上用物理方法分离提纯二氧化硫的实验方案:
熔点/℃
沸点/℃
密度/g∙L-1(标准状况)
O2
-218
-183
1.429
SO2
-76
-10
2.9
N2
-210
-196
1.25
-
(2) SO2→Na2S2O4步骤中氧化剂与还原剂的物质的量之比为。制得的Na2S2O4溶液冷却至50℃,过滤,用洗涤,干燥,制得Na2S2O4。
-
(3) Na2FeO4与KCl发生复分解反应制备K2FeO4 , 说明相同温度下K2FeO4的溶解度(填“ > ”、“ < ”或=”) Na2FeO4的溶解度。
-
(4) 溶液中的Na2S2O4易被空气中的氧气氧化生成NaHSO3 , 反应的离子方程式为
-
(5) 在制备Na2FeO4时,现象是先生成红褐色沉淀,随后转化成绿色溶液,生成了 Na2FeO4。
①写出红褐色沉淀转化为Na2FeO4的化学方程式:。
②为探究Na2FeO4和Cl2的氧化性相对强弱,取少量上述绿色溶液于试管中,滴加适量浓盐酸,产生能使湿润的KI淀粉试纸变蓝色的气体,不能说明Na2FeO4的氧化性比Cl2的氧化性强,理由是。
| A | B | C | D |
| | | | |
| 验证C的非金属性强于Si | 比较Fe2+和Cr3+还原性强弱 | 比较碳酸钠与碳酸氢钠的热稳定性 | 制备氢氧化铁胶体 |
 ,B为+3价)是高能储氢燃料,由其制成的燃料电池性能稳定,放电效率高,工作原理如图所示。该电池工作时,下列说法正确的是( )
,B为+3价)是高能储氢燃料,由其制成的燃料电池性能稳定,放电效率高,工作原理如图所示。该电池工作时,下列说法正确的是( ) 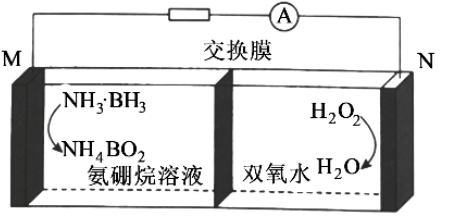
 ,正极区溶液质量增加1g
,正极区溶液质量增加1g
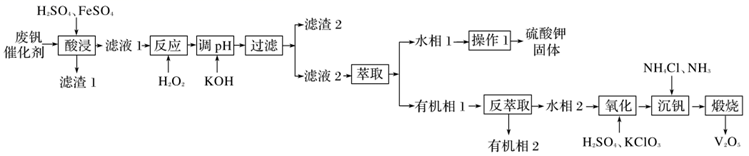
已知:①“酸浸”时V2O5和V2O4先与稀硫酸反应分别生成VO  和VO2+。
和VO2+。
②有机萃取剂萃取VO2+的能力比萃取VO  的能力强。
的能力强。
③溶液中VO  与VO
与VO  可相互转化:VO
可相互转化:VO  +H2O
+H2O  VO
VO  +2H+。
+2H+。
-
(1) “酸浸”时,FeSO4的作用是。
-
(2) 滤渣2的成分主要有(填化学式)。
-
(3) “萃取”和“反萃取”时,将发生R2(SO4)n(水层)+2nHA(有机层)
 2RAn(有机层)+nH2SO4(水层)(R表示VO2+ , HA表示有机萃取剂),“反萃取”操作加入的试剂是(填化学式)。
2RAn(有机层)+nH2SO4(水层)(R表示VO2+ , HA表示有机萃取剂),“反萃取”操作加入的试剂是(填化学式)。
-
(4) “氧化”过程中发生反应的离子方程式为。若该废钒催化剂中V2O5的含量为10%(原料中所有的钒已换算成V2O5)。该厂检验科实验室取100g待处理样品,按照上述流程进行实验。当加入150 mL 0.1 mol·L-1的KClO3溶液时,溶液中的钒元素恰好完全反应,则该工艺中钒的最大回收率是%(假设与KClO3反应后的操作步骤中钒元素无损失)。
-
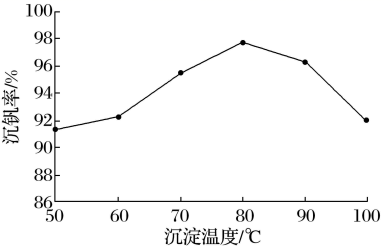
(5) 沉钒率是回收钒的关键之一。
①“沉钒”时,钒元素主要以形式存在(填相应的离子符号)。
②实验发现,温度超过80℃以后沉钒率下降(如图),可能的原因是。
 =BaSO4↓
B . CH4在光照条件下与Cl2反应:CH4+Cl2
=BaSO4↓
B . CH4在光照条件下与Cl2反应:CH4+Cl2 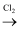 CH3Cl+HCl
C . 向氯化铝溶液中滴加过量氢氧化钠溶液:Al3++3OH-=Al(OH)3↓
D . 碳酸钙溶于盐酸:
CH3Cl+HCl
C . 向氯化铝溶液中滴加过量氢氧化钠溶液:Al3++3OH-=Al(OH)3↓
D . 碳酸钙溶于盐酸:  +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
| 选项 | 操作及现象 | 结论 |
| A | 向某溶液中加入几滴KSCN溶液和少量新制的氯水,弱溶液变为血红色 | 原溶液中一定含有Fe3+ |
| B | 加入盐酸无沉淀生成,再加氯化钡溶液,产生白色沉淀 | 该溶液中一定含有硫酸盐 |
| C | 加入少量盐酸,没有产生能使澄清石灰水变浑浊的气体 | 该溶液中一定不含 |
| D | 向某溶液中先加几滴淀粉溶液,无明显现象,再滴氯水,溶液变蓝 | 溶液中一定含有I- |
 ②稀硝酸③纯醋酸④
②稀硝酸③纯醋酸④  ⑤空气
⑤空气  ⑥
⑥  ⑦
⑦  胶体⑧
胶体⑧  晶体⑨
晶体⑨ 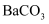 ⑩碘酒
⑩碘酒
-
(1) 能导电的物质;(用序号填空,下同)
-
(2) 电解质,但熔融状态下并不导电。
-
(3) 非电解质;
-
(4) 区分
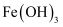 胶体和
胶体和  溶液实验方法(具体操作);
溶液实验方法(具体操作);
-
(5) 写出②和⑨反应的离子方程式。
-
(6) 向
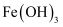 胶体中逐滴滴入过量的盐酸,会出现一系列变化,先出现,原因:,随后,原因(用离子方程式表示)。
胶体中逐滴滴入过量的盐酸,会出现一系列变化,先出现,原因:,随后,原因(用离子方程式表示)。
 B . Fe加到
B . Fe加到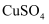 溶液中:
溶液中: C . 氧化铜与盐酸混合:
C . 氧化铜与盐酸混合: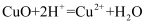 D . 氯气与水反应:
D . 氯气与水反应:
 ——酸性氧化物
D .
——酸性氧化物
D . 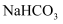 ——酸式盐
——酸式盐
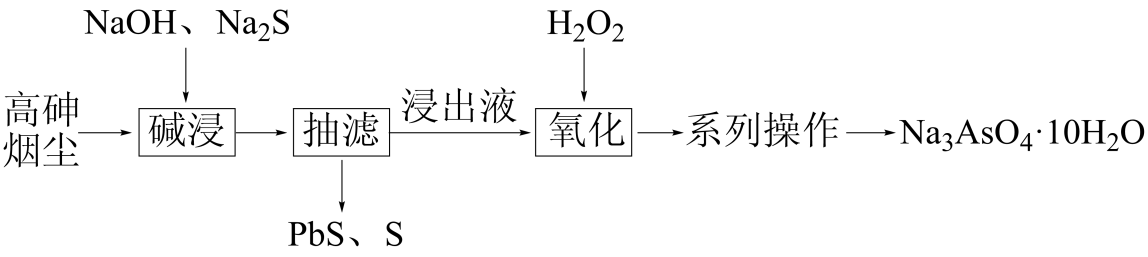
下列说法错误的是( )
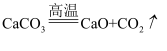 B .
B .  C .
C . 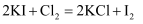 D .
D .