第三节 硫和氮的氧化物 知识点题库
某研究性学习小组,为研究光化学烟雾消长规律,在一烟雾实验箱中,测得烟雾的主要成分为RH(烃)、NO、NO2、O3、PAN(CH3COOONO2),各种物质的相对浓度随时间的消失,记录于右图,根据图中数据,下列推论最不合理的是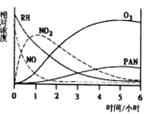
利用下图所示装置收集以下8种气体(图中烧瓶的位置不得变化)
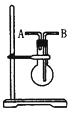
①H2 ②Cl2 ③CH4 ④HCl ⑤NH3 ⑥NO ⑦H2S ⑧SO2
-
(1) 若烧瓶是干燥的,则由B口进气收集的气体有(写序号)。
-
(2) 若烧瓶充满水,可收集的气体有,这时气体由进入。
-
(3) 若烧瓶是干燥的,则由A口进气,可收集的气体有。
-
(4) 若在烧瓶内装入浓硫酸使气体干燥,则可用此装置来干燥的气体有,这时气体由口进入。
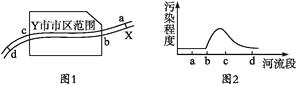
根据2013年市环保局监测站对X河水质检测结果绘制的简图如图2所示。请据图示回答下列问题:
-
(1) 造成X河水质污染的主要污染源最可能分布在( )A . ab段 B . bc段 C . cd段 D . bd段
-
(2) 列举造成X河污染的三种可能的污染源。
-
(3) 若对c处水样进行检测,发现其中含有Cu2+等重金属离子。若要把铜离子变为单质铜回收,请回答两种回收的方法:
方法Ⅰ:
方法Ⅱ:
-
(4) d处的污染程度明显降低,请从物理学、化学、生物学三方面简单说明其原因。
下列元素在一定条件下能实现“单质 氧化物
氧化物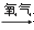 氧化物
氧化物 酸”直接转化的是( )
酸”直接转化的是( )
-
(1) 引起温室效应的主要气体是(填序号,下同). ①SO2 ②CO2
-
(2) 能形成酸雨的物质是①硫的氧化物 ②碳的氧化物 ③氮的氧化物.
某工业废水中含有CN﹣和Cr2O72﹣等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理,回答下列问题:
-
(1) 步骤②中,CN﹣被ClO﹣氧化为CNO﹣的离子方程式为:.
-
(2) 步骤③的反应为S2O32﹣+Cr2O72﹣+H+→SO42﹣+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72﹣转移mol e﹣ .
-
(3) 含Cr3+废水可以加入熟石灰进一步处理,目的是.
-
(4) 在25℃下,将a mol•L﹣1的NaCN溶液与0.01mol•L﹣1的盐酸等体积混合,反应后测得溶液pH=7,则a0.01(填“>”、“<”或“=”).
-
(5) 取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀.该过程中反应的离子方程式是:,.

-
(1) 吸硫装置如图所示。
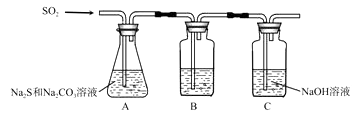
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ,表明SO2吸收效率低的实验现象是B中溶液 。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 。(答一条)
-
(2) 假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)。
序号
实验操作
预期现象
结论
①
取少量样品于试管中,加入适量蒸馏水,充分振荡溶解, 。
有白色沉淀生成
样品含NaCl
②
另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,。
有白色沉淀生成,上层清液pH>10.2
样品含NaOH
-
(3) Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取a g KIO3(相对分子质量为214)固体配成溶液;
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂;
第三步: 用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。
则c(Na2S2O3)=mol·L-1。
已知:IO3-+5I-+6H+= 3I2+3H2O ,2S2O32-+I2=S4O62-+2I-
-
(4) 某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能(填“不受影响”、“偏低”或“偏高”),原因是。(用离子方程式表示)。
①能使澄清石灰水变浑浊
②能使品红溶液褪色
③能使湿润的蓝色石蕊试纸变红
④通入足量的NaOH溶液,再加入BaCl2溶液有白色沉淀产生,该沉淀溶于盐酸
⑤通入溴水能使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀产生
-
(1) 下列物质不属于环境监测中污染物的是 。A . SO2 B . NO2 C . CO2 D . 可吸入颗粒
-
(2) 目前我国仍然是煤炭为主的能源结构。而煤炭燃烧易产生(填“二氧化碳”或者“二氧化硫”)气体而导致酸雨。
-
(3) 在水体污染治理中,处理含Cu²+、Hg2+等重金属离子的废水常用 (填“沉淀法”或者“过滤法”)。
-
(4) 沿海地区常常用淡化海水来补充淡水资源的不足。下列方法常用于海水淡化的是 (双选,错选漏选不得分)。A . 蒸馏法 B . 电渗析法 C . 过滤法 D . 分液法
 和
和 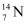 互为同位素
B . 石英与水晶互为同素异形体
C . 淀粉和纤维素互为同分异构体
D . 乙酸和硬脂酸互为同系物
互为同位素
B . 石英与水晶互为同素异形体
C . 淀粉和纤维素互为同分异构体
D . 乙酸和硬脂酸互为同系物
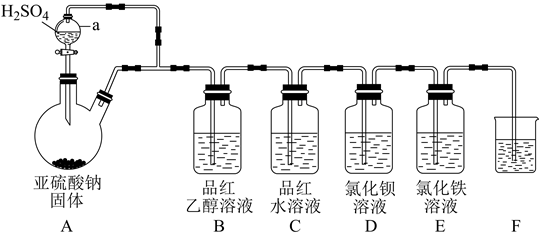
-
(1) 仪器a的名称为,实验时装置E中溶液的现象为。
-
(2) 若装置B中溶液无明显现象,装置C中溶液红色褪去,则使品红的水溶液褪色的含硫微粒一定不是(填化学式)。
-
(3) 该实验小组的甲、乙两位同学为了进一步探究SO2的漂白性,按如图装置继续进行实验并记录相关实验现象。
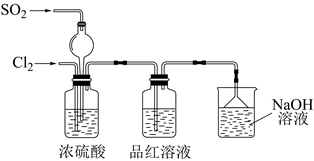
①装置中浓硫酸的作用为。
②根据表中实验现象做出合理解释。
组别
实验现象
合理解释
甲
品红溶液几乎不褪色
反应方程式为
乙
品红溶液随时间的推移变得越来越浅
原因可能是
-
(4) 该实验小组的学生丙预测装置D中没有白色沉淀产生,但随着反应的进行,发现装置D中产生了少量白色沉淀。为进一步探究产生沉淀的原因,分别用煮沸和未煮沸过的蒸馏水配制的Ba(NO3)2和BaCl2溶液,进行如图实验:
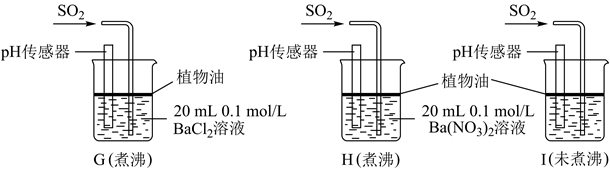 实验中G、H、I烧杯中观察到的现象如表:
实验中G、H、I烧杯中观察到的现象如表:烧杯
实验现象
G
无白色沉淀产生,pH传感器测的溶液pH=5.3
H
有白色沉淀产生
I
有白色沉淀产生,I中出现白色沉淀比H中快很多
①据G中现象推测D中产生的白色沉淀的化学式是。
②写出H中白色沉淀产生的离子方程式。
③据I中出现白色沉淀的速率比H中快很多的现象,推测其根本原因可能是。
-
(5) 该实验小组的学生丁用200mL0.1mol•L-1酸性KMnO4溶液测定空气中SO2含量,若气体流速为acm3•min-1 , 当tmin时酸性KMnO4溶液恰好褪色,则空气中SO2的含量为(g•cm-3)。
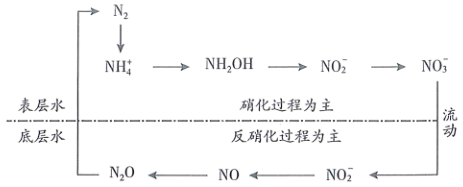
下列说法错误的是( )
 废水不会影响水体中
废水不会影响水体中  的浓度
的浓度
 的喷泉实验说明氨气极易溶于水
的喷泉实验说明氨气极易溶于水



