实验2-3 从海带中提取碘 知识点题库
位验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验).

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a.
Ⅳ.…
(1)A中反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,则氧化性KMnO4 Cl2(填“>”“<”或“=”).
(2)验证氯气的氧化性强于碘的实验现象是 .
(3)B中溶液发生反应的离子方程式是 .
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 .
(5)浸有NaOH溶液的棉花团的作用是 .
-
(1) 化学实验操作的“先”与“后”,对化学实验结果、师生安全等具有十分重要的意义.我们在进行化学实验时,若遇到下列情况,应如何操作.
①给试管中的药品加热,必须先,后集中加热.
②点燃可燃性气体(如H2、CO等)时,都要先,后点燃.
③H2还原CuO实验结束时,要先,后移去导气管.
-
(2) 要分离下列四组混合物:a.饱和食盐水与沙子 b.从KNO3和NaCl的混合溶液中获得KNO3 c.水和汽油的混合物 d.CCl4液体与甲苯液体的混合物(已知CCl4与甲苯互溶,沸点分别为76.75℃和110.6℃)
①分离a、b的操作分别为、.
②上述四组分离时需使用酒精灯的有和(填序号).
③分离c时所使用仪器中有一种在其他组分分离时无需使用,这种仪器是
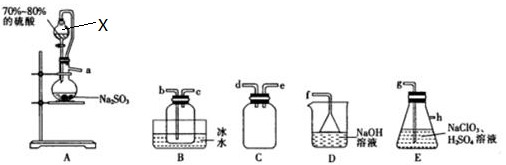
回答下列问题:
-
(1) 仪器X的名称是。
-
(2) 欲选择上图中的装置收集ClO2 , 其连接顺序为a→(按气流方向,用小写字母表示)。
-
(3) 装置C的作用是,装置E中反应的离子方程式为。
-
(4) 处理含硫(Na2S)碱性废水时,ClO2与Na2S反应(S2-被氧化为SO42-)的离子方程式为;处理含硫碱性废水时,相同条件下同体积的ClO2相对于Cl2的优点是。
-
(5) ClO2很不稳定,需现用现配,为测定所得溶液中ClO2的含量,进行下列实验:
步骤1:准确量取V1 mL ClO2溶液加入锥形瓶中。
步骤2:用稀硫酸调节ClO2溶液的pH≤2.0,再加入足量KI晶体,静置片刻。
步骤3:加入指示剂,用c mol·L-1的Na2S2O3标准溶液滴定至终点时,消耗V2 mL Na2S2O3标准溶液。
(已知:2ClO2+8H++10I-=2Cl-+5I2+4H2O;2S2O32-+I2=2I-+S4O62-)
①配制100mL c mol·L-1 Na2S2O3标准溶液时,用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和。
②原溶液中ClO2的含量为(用含c、V1、V2的代数式表示)g·L-1。
| 相关实验 | 预期目的 | |
| ① | 在两份同浓度同体积的H2O2溶液中,分别加2滴FeCl3溶液和2滴CuCl2溶液,前者放在热水中,后者放在冰水中。观察气泡快慢; | 验证温度对化学反应速率的影响。 |
| ② | 将氯水加入淀粉KI溶液中 | 验证Cl的非金属性比I强 |
| ③ | 在相同温度下,将表面积相同的铝条和镁条投入等体积同浓度的盐酸中,观察产生气泡的速率。 | 比较同周期金属元素的金属性强弱。 |
| ④ | 利用电解质溶液的导电性装置,检测AlCl3溶液的导电性 | 证明AlCl3是离子化合物 |
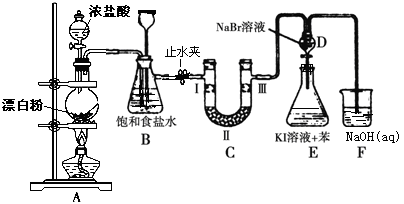
-
(1) 写出A装置生成氯气的化学反应方程式。
-
(2) 装置B除及吸收HCl外还有两个作用, 请写出: ,。
-
(3) 装置C的实验目的是验证氯气是否具有漂白性, 为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是(填编号)。
编号
1
2
3
4
Ⅰ
干燥的有色布条
湿润的有色布条
干燥的有色布条
湿润的有色布条
Ⅱ
碱石灰
无水氯化钙
硅胶
浓硫酸
Ⅲ
湿润的有色布条
干燥的有色布条
湿润的有色布条
干燥的有色布条
-
(4) 设计装置D、E的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是该现象(填“能”或“不能”)说明溴的非金属性强于碘,原因是。
-
(5) 有人提出,装置F中可改用足量的Na2S2O3溶液吸收余氯,试写出相应的离子方程式:。
①过滤 ②加过量的NaOH溶液 ③加适量HCl ④加过量的Na2CO3溶液 ⑤加过量的  溶液
溶液
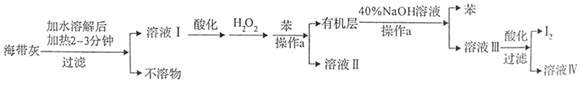
-
(1) 操作a的名称为。向酸化的溶液I中加入H2O2的目的为。
-
(2) 灼烧时需要用到的主要仪器。
a.蒸发皿 b.烧杯 c.酒精灯 d.泥三角 e.坩埚 f.蒸馏烧瓶
-
(3) 已知I2与40%的NaOH溶液反应生成的氧化产物和还原产物的物质的量之比为1:5,写出对应的化学方程式。
-
(4) 最后过滤得到的I2需要进行洗涤和干燥,下列洗涤剂中最应该选用的是______。A . 水 B . 乙醇 C . 冷水 D . 乙醇的水溶液
-
(5) 用Na2S2O3的标准溶液测定产品的纯度,发生反应:I2 + 2Na2S2O3 = Na2S4O6 + 2NaI。取5.0g产品,配制成100mL溶液。取10.00mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol·L-1Na2S2O3的标准溶液进行滴定,滴定时,达到滴定终点的现象是。
 8Cu+4FeO+2Fe2O3+16SO2。
8Cu+4FeO+2Fe2O3+16SO2。
-
(1) 若CuFeS2中Fe的化合价为+2价,则反应中的氧化产物是(填化学式)。
-
(2) 上述冶炼过程中会产生大量SO2 , 下列处理方案中合理的是_______(填字母)。A . 高空排放 B . 用于制备硫酸 C . 用纯碱溶液吸收制Na2SO3 D . 用浓硫酸吸收
-
(3) 验证黄铜矿冶炼铜的反应所得气体中含有SO2的方法是。
-
(4) 实验室制备、收集干燥的SO2 , 所需装置如图。
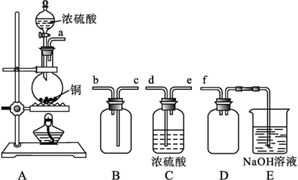
①装置A产生SO2 , 反应的化学方程式为。
②按气流方向连接各仪器接口,顺序为a→→→→→f,装置E中NaOH溶液的作用是吸收多余的SO2 , 该反应的离子方程式为。
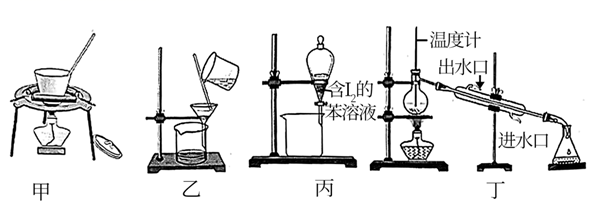

已知:“沉淀”时需控制温度在0℃左右;  为白色晶体,微溶于水,不溶于乙醇等有机溶剂,加热至366℃时开始分解放出氧气。
为白色晶体,微溶于水,不溶于乙醇等有机溶剂,加热至366℃时开始分解放出氧气。
-
(1) “沉淀”需使用如图装置。

①“沉淀”装置连接顺序为(填接口序号)。
②橡胶管X的作用是。
③B中反应需在冰水浴中进行,除了便于析出晶体外,另一个原因是。
④B中反应的离子方程式为。
-
(2) ①“沉淀”通入
 的作用是。
的作用是。 ②洗涤
 ,最佳试剂是(填序号)。
,最佳试剂是(填序号)。A.水 B.无水乙醇
-
(1) I.粗盐中含有较多的杂质,化学兴趣小组同学按照课本“活动与探究”的要求做粗盐提纯实验。
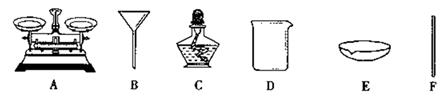
“活动与探究”中,操作步骤有:①计算产率、②过滤、③溶解、④蒸发,正确的操作顺序为(填序号)。
-
(2) 仪器B的名称是,在实验中三个步骤中都须使用的一种仪器是(填序号)。
-
(3) 称量食盐应放在仪器A的盘,蒸发时防止液滴飞溅的操作是。
-
(4) II.化学兴趣小组同学欲除去固体氯化钠中混有的氯化钙。设计实验方案如下,请参与实验并回答问题。
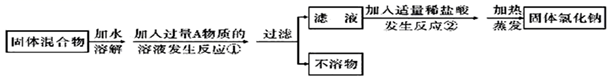
写出A物质的化学式:,写出A物质的俗称:。
-
(5) 写出反应②的化学方程式:。
-
(6) 反应①中加入过量A物质的目的是;反应②中如果加入盐酸也过量,则对所得到的氯化钠纯度(填“有”或“没有”)影响。
-
(7) 分离后所得氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果(填“增大”、“不变”或“减少”)。
-
(8) III.化学活动小组查阅资料发现,粗盐中除NaCl外,还含有MgCl2、CaCl2、MgSO4以及泥沙等杂质。他们要除去杂质得到精盐,设计了下列实验方案(序号①~⑧表示实验操作,用于沉淀的试剂稍过量):

根据上述方案,回答下列问题:
操作①中玻璃棒的作用是。
-
(9) 第⑤步操作的名称是。
-
(10) “蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、石棉网、火柴、玻璃棒、、酒精灯。
-
(11) 实验中加入“Na2CO3溶液”的目的是。
-
(12) 利用提供的沉淀试剂,另写出一种添加试剂的操作顺序(填序号):。
-
(13) IV.化学兴趣小组同学模拟“海水淡化工业”来制取蒸馏水。实验装置图如下:
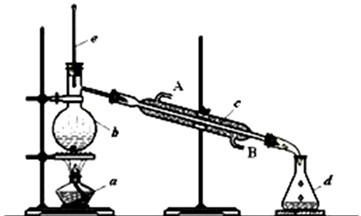
仪器c的名称是。
-
(14) 该分离混合物的原理是利用 不同,通过加热的方式使其分离。
-
(15) 冷水进水端是端( 填 A或B )
-
(16) 为防暴沸需向 (填仪器名称)中加入 (填物品)。
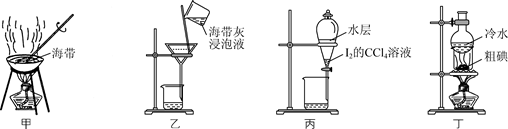
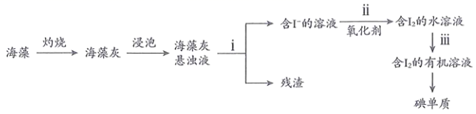
-
(1) 指出上述过程中有关实验操作的名称,步骤i:,步骤iii:。
-
(2) 步骤ii中可使用
 ,从原子结构角度说明理由:。
,从原子结构角度说明理由:。  过量时,可能无法获得
过量时,可能无法获得  ,原因是
,原因是  会被继续氧化为
会被继续氧化为  ,该反应的离子方程式为。
,该反应的离子方程式为。
-
(3) 当使用
 做氧化剂时,
做氧化剂时,  的转化率受外界因素的影响如下图所示。
的转化率受外界因素的影响如下图所示。 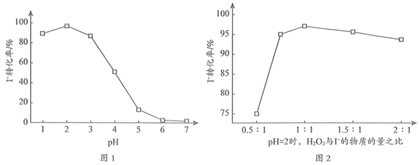
①图1中,
 时
时  转化率几乎为0,结合离子方程式解释原因:。
转化率几乎为0,结合离子方程式解释原因:。②图2中,
 与
与  物质的量之比从0.5﹕1提高至1﹕1时,
物质的量之比从0.5﹕1提高至1﹕1时,  的转化率明显增大,可能的原因是(写出2条)。
的转化率明显增大,可能的原因是(写出2条)。
 , 进一步处理得到产品
, 进一步处理得到产品 和
和 。下列说法错误的是( )
。下列说法错误的是( )
 时,仪器接口的符合题意连接顺序是a→g h→b c→e f
B . ②中使用雾化装置的优点是使氨盐水雾化,增大与
时,仪器接口的符合题意连接顺序是a→g h→b c→e f
B . ②中使用雾化装置的优点是使氨盐水雾化,增大与 的接触面积,提高产率
C . 将②中的混合物处理可得到
的接触面积,提高产率
C . 将②中的混合物处理可得到 固体,该步操作用到的玻璃仪器主要有:烧杯、漏斗、玻璃棒
D . 侯氏制碱法的工艺过程中应用了物质溶解度的差异
固体,该步操作用到的玻璃仪器主要有:烧杯、漏斗、玻璃棒
D . 侯氏制碱法的工艺过程中应用了物质溶解度的差异



